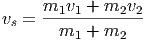

In vielen Experimenten beobachtet man, dass potentielle Energie oder kinetische Energie in Wärme umgewandelt werden kann. Beispiele hierfür sind der vollkommen plastische Stoss, Reibungswärme oder die Verlustleistung an Widerständen.
Wenn in einer Dimension zwei Massen m1 und m2 mit den Geschwindigkeiten v1 und v2 plastisch aufeinander stossen, wird ein Teil der kinetischen Energie in Wärme und Deformation umgewandelt. Dieser Teil wird am einfachsten im Schwerpunktssystem berechnet. Die Schwerpunktsgeschwindigkeit ist
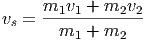 | (2.1) |
Im Schwerpunktssystem ist die kinetische Energie der beiden Massen
| Ekin,r | = 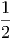 m1 m1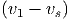 2 + 2 + 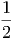 m2 m2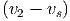 2 2 | ||
= 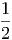 m1 m1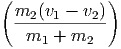 2 + 2 +  m2 m2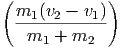 2 2 | |||
= 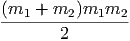 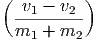 2 2 | |||
= 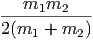 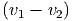 2 2 | (2.2) |
Im vollkommen plastischen Falle wir die Energie Ekin,r in Deformation oder in Wärme umgewandelt.
 Versuch zur Vorlesung: Umwandlung
von Energie in Wärme (Versuchskarte TH-110)
Versuch zur Vorlesung: Umwandlung
von Energie in Wärme (Versuchskarte TH-110)
Was ist Wärme? Demokrit in Griechenland stellte die Vermutung auf, dass Materie aus kleinsten, unteilbaren Teilchen bestehen würde. Beobachtungen mikroskopisch kleiner Partikel (Brown) führen zum Schluss, dass Flüssigkeiten und Gase aus noch viel kleineren Teilchen (d « 1μm) bestehen. Dabei sollen diese Teilchen in einer reinen Substanz die immer gleichen Massen mi haben.
In (kristallinen) Festkörpern laufen hochfrequente Schallwellen (heute unter dem Namen Phononen bekannt). Schallwellen sind in jedem Falle an das Vorhandensein von Materie gebunden (im Vakuum gibt es keinen Schall).
| Wärmeenergie ist kinetische Energie von
Atomen oder Molekülen oder anderen Teilchen. |
Jedes dieser Teilchen hat zur Zeit t die Geschwindigkeit vi(t) und damit die mittlere kinetische Energie
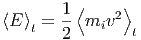 |
Da alle Teilchen identisch sein sollen wird die mittlere kinetische Energie für alle Teilchen gleich sein.
Wie wird nun erreicht, dass alle Teilchen die gleiche kinetische Energie haben? Bei elastischen Stössen werden Energien neu verteilt. Im Mittel bewirken elastische Stösse, dass kinetische Energie vom schnelleren auf das langsamere Teilchen übertragen wird, Stossprozesse gleichen also die Energie aus.
Die mittlere kinetische Energie pro Teilchen ist eine charakteristische Grösse für ein physikalisches System. Unter diesem System verstehen wir eine Anzahl gleicher oder unterschiedlicher Teilchen, die entweder als Punktmassen (ideales Gas) oder aber als ausgedehnte Körper verstanden werden.
Wenn wir zwei Systeme mit unterschiedlichen mittleren kinetischen Energien pro Teilchen in Kontakt bringen, wir Energie aus dem System mit der höheren mittleren kinetischen Energie in das andere System verschoben bis ein Gleichgewicht erreicht wird.
Aus dem Alltag wissen wir, dass wenn zwei System mit unterschiedlicher Temperatur T in Kontakt gebracht werden, diese mit der Zeit die gleiche Temperatur erreichen. Das System mit der höheren Temperatur wird zu einer niederen Temperatur abgekühlt, das kältere System erwärmt sich.
| Postulat: die mittlere
kinetische Energie pro Teilchen wird durch die
Temperatur T beschrieben. |
Die Temperatur T wird in Kelvin ([T] = K) oder Grad Celsius (T = 0C) gemessen. Dabei gilt
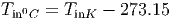 | (2.3) |
Bemerkung: Grad Celsius in englisch heisst „degree centigrade“.
Der nullte Hauptsatz beschreibt die Relation der Temperaturen dreier Systeme A, B und C.
| Ist ein System A im thermischen Gleichgewicht
mit einem System B und ist dieses System B
im thermischen Gleichgewicht mit dem System
C, so ist auch das System A im Gleichgewicht
mit dem System C. Alle drei Systeme haben die
gleiche Temperatur T. |
In diesem Abschnitt wollen wir unter möglichst allgemeinen Annahmen Aussagen über die relative Häufigkeit mit der ein System im Energieintervall [E,E + δE) zu finden ist. Diese Häufigkeit findet man, indem man viele System mit den gleichen Randbedingungen untersucht und dabei die Anzahl der Teilchen, die in das Energieintervall [E,E + δE) fallen durch die Zahl aller Teilchen teilt. Die so erhaltene Funktion f(E) heisst Energiedichte oder Energieverteilungsfunktion.
Die Abbildung 2.1.2 zeigt eine Energieverteilungsfunktion f(E).
Sei f die Energieverteilungsfunktion d.h. in
die Energieverteilungsfunktion d.h. in
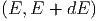 gibt es f
gibt es f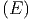 dE Teilchen. Wir betrachten
nun den Stoss eines Teilchens aus dem Energieintervall
dE Teilchen. Wir betrachten
nun den Stoss eines Teilchens aus dem Energieintervall
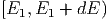 mit einem Teilchen aus dem Energieintervall
mit einem Teilchen aus dem Energieintervall
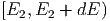 .
.
Die Wahrscheinlichkeit, ein Teilchen aus dem Intervall
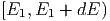 zu finden ist f
zu finden ist f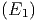 dE, die Wahrscheinlichkeit,
ein Teilchen aus dem Intervall
dE, die Wahrscheinlichkeit,
ein Teilchen aus dem Intervall 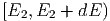 zu finden ist
f
zu finden ist
f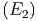 dE.
dE.
Die Wahrscheinlichkeit pvorher, diese zwei Teilchen gleichzeitig zu finden ist
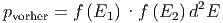 |
Nach dem Stoss befinden sich die Teilchen in neuen
Energieintervallen 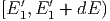 und
und 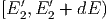 . Hier ist
die Wahrscheinlichkeit pnachher für diesen Stoss
. Hier ist
die Wahrscheinlichkeit pnachher für diesen Stoss
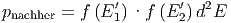 |
Die beiden Wahrscheinlichkeiten pvorher und pnachher beschreiben, wie wahrscheinlich es ist, zwei Teilchen in den jeweiligen Zuständen zu finden.
| Physikalische Systeme bewegen sich immer in
die Richtung grösserer Wahrscheinlichkeit. |
Ein thermodynamisches System, das heisst eine Anzahl (Ensemble) von Teilchen ist dann im Gleichgewicht, wenn Stösse von den ungestrichenen Energieintervallen in die gestrichenen gleich wahrscheinlich sind, wie Stösse aus den gestrichenen Energieintervallen in die ungestrichenen. Dies wird als Gleichung wie folgt ausgedrückt:
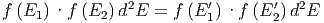 |
Da unser Argument unabhängig sein muss von der Breite des betrachteten Energieintervalls, kann man auch schreiben
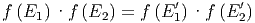 | (2.4) |
Wenn die Energien E1 und E2 gegeben sind, können die Energien E1′ und E2′ nicht mehr ganz frei gewählt werden. Die Energieerhaltung bei einem ideal elastischen Stoss fordert:
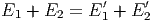 | (2.5) |
Hätten wir keine elastischen Stösse, würde dies bedeuten, dass die Teilchen (Atome oder Moleküle) ihre innere Struktur verändern. Zum Beispiel könnten Schwingungen angeregt werden, oder es könnten chemische Reaktionen ausgelöst werden. Im Weiteren wollen wir annehmen, dass Stösse elastisch ablaufen.
Die eine Endzustandsenergie, E1′, kann im Intervall
![[0,E1 + E2]](td-201549x.png) frei gewählt werden. E2′ ist dann gegeben.
frei gewählt werden. E2′ ist dann gegeben.
Wenn wir nun in Gedanken E1 und E2 festhalten und und E1′ im erlaubten Intervall variieren, sehen wir, dass bei gegebener Summe E1 + E2 das Produkt der Wahrscheinlichkeiten und damit auch der Wahrscheinlichkeitsdichten konstant sein muss. Es kann also nur von E1 + E2 abhängen.
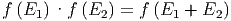 | (2.6) |
Welche mathematische Funktion hat die Eigenschaft, dass das Produkt der Funktion zweier Argumente gleich der Funktion der Summe dieser Argumente ist? Wir erkennen sie sofort, wenn wir Gleichung (2.6) logarithmieren.
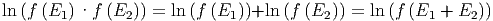 |
Wir sehen also, dass ln(f)(E) eine lineare Funktion ist. Das heisst f(E) muss die Exponentialfunktion sein.
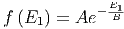 | (2.7) |
B ist zuerst eine Konstante mit der Dimension der Energie, die das Argument der Exponentialfunktion dimensionslos macht.
Der Vorfaktor A kann über die Normierungsbedingung
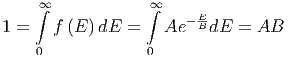 |
Also ist A = 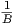 . Die mittlere Energie berechnet sich aus
(Integraltabelle E.1)
. Die mittlere Energie berechnet sich aus
(Integraltabelle E.1)
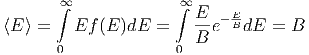 | (2.8) |
Offensichtlich muss in ein und demselben thermodynamischen System B gleich sein.
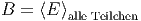 | (2.9) |
Weiter sehen wir, dass wir kein System im Zustand unendlicher Energie finden werden.
Die Funktion f(E) hat für B = 0 bei E = 0 einen unbestimmten Wert. Überall sonst ist f(E) = 0. Das bedeutet, dass damit jegliche Bewegung gestoppt ist. Man definiert nun, dass die Temperatur proportional zur mittleren kinetischen Energie der Gasteilchen sein soll
| Temperatur: Mass für die mittlere kinetische
Energie der Teilchen |
An diesem Punkt müssen wir aufpassen. Wir haben bei der
Berechnung der Mittelwerte in Gleichung (2.8) uns keine
Gedanken gemacht, dass die kinetische Energie ja von der
vektoriellen Grösse Geschwindigkeit 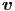 abhängt. Unsere
Überlegung war richtig, der Vorfaktor des Resultates muss
jedoch diskutiert werden (siehe Abschnitt 2.5). Genauere
Rechnungen zeigen, dass
abhängt. Unsere
Überlegung war richtig, der Vorfaktor des Resultates muss
jedoch diskutiert werden (siehe Abschnitt 2.5). Genauere
Rechnungen zeigen, dass
Die Temperatur Temperatur wird in Kelvin gemessen (nicht in Grad Kelvin!). Aus der Boltzmannverteilung Gleichung (2.10) folgt, dass es einen absoluten Temperaturnullpunkt gibt.
| Kelvin | Celsius | Bemerkungen |
| 0K | -273.150C | absoluter Nullpunkt |
| 273.15K | 00C | Schmelztemperatur Eis unter Normaldruck |
| 273.16K | 0.010C | Tripelpunkt Wasser: Definiert die Kelvin-Skala |
| 373.15K | 1000C | Siedepunkt des Wassers unter Normaldruck |
Anwendung: Die Ausströmgeschwindigkeit eines gases ins Vakuum ist im Mittel
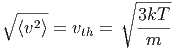 |
Dabei ist die Schallgeschwindigkeit c kleiner als die mittlere thermische thermische Ausströmgeschwindigkeit c < vth. Dies ist verständlich, da bei einer Schallwelle die Störung lokal ungerichtet mit vth in die Ausbreitungsrichtung transportiert wird.
Üblicherweise wird die temperaturabhängige Länge eines Objektes zur Temperaturmessung ausgewertet.
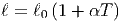 | (2.12) |
Hier ist α der Ausdehnungskoeffizient des Materials. Typische Ausdehnungskoeffizienten liegen im Intervall
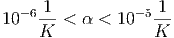 |
In der Gleichung (2.11) steht der Vorfaktor 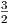 vor kT. Dieser
Vorfaktor hängt von den Freiheitsgraden der Bewegung ab.
Was ist ein Freiheitsgrad?
vor kT. Dieser
Vorfaktor hängt von den Freiheitsgraden der Bewegung ab.
Was ist ein Freiheitsgrad?
Die Geschwindigkeit im Raum wird durch einen
dreidimensionalen Vektor 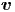 gegeben. Wenn der Betrag der
Geschwindigkeit |
gegeben. Wenn der Betrag der
Geschwindigkeit |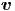 | = v gegeben ist, können von den drei
Komponenten vx, vy und vz noch zwei (in grenzen) frei
gewählt werden, da gilt
| = v gegeben ist, können von den drei
Komponenten vx, vy und vz noch zwei (in grenzen) frei
gewählt werden, da gilt
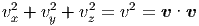 |
Insgesamt sind also 3 Werte frei wählbar. In der Sprache der Thermodynamik (Wärmelehre heisst dies, dass 3 Freiheitsgrade existieren. jede Punktmasse hat also drei Freiheitsgrade.
Ausgedehnte Körper wie zum Beispiel ein H2O-Molekül können im Raum rotiert werden. Diese Rotation kann durch die 3 Eulerwinkel beschrieben werden1 . Neben den drei Freiheitsgraden der Translation existieren also bis zu drei Freiheitsgrade der Rotation. ⇒ 3 Freiheitsgrade (wenn
| Anzahl Atome | Freiheitsgrade |
| 1 | 3 |
| 2 | 5 |
| 3 und mehr in einer Linie | 5 |
| 3 und mehr sonst | 6 |
Weitere Freiheitsgrade kommen hinzu, wenn die Schwingungen in den Molekülen mitberücksichtigt werden. Die quantenmechanische Betrachtung zeigt, dass bei tiefen Temperaturen diese Schwingungsfreiheitsgrade nicht angeregt werden können. Ähnlich verhält es sich mit den Freiheitsgradendie zu Rotationen um Molekülbindungen gehören.
Das ursprüngliche Argument, dass Stösse zwischen punktförmigen Gasatomen zum Erreichen eines energetischen Gleichgewichtszustandes notwendig sind, gilt für alle Freiheitsgrade.
Das Äquipartitionsgesetz besagt, dass die mittlere Energie pro Freiheitsgrad für alle Freiheitsgrade unabhängig von ihrem Charakter gleich ist.
| EFreiheitsgrad | = 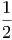 kT kT | ||
| EMolekül | = 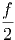 kT kT | (2.13) |
wobei f die Anzahl der Freiheitsgrade ist.
Wir haben gesehen, dass die Energie pro Molekül
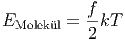 |
ist. Um die Temperatur also um ΔT zu erhöhen, brauchen wir die Energie
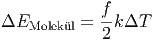 | (2.14) |
Ein Gasvolumen mit der Masse M aus Molekülen der Masse m beinhaltet dann
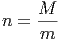 |
Moleküle. Die zur Temperaturerhöhung notwendige Energie ist also
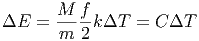 |
Die Grösse C ist die Wärmekapazität des Körpers
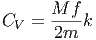 | (2.15) |
Der index V besagt, dass dabei das Volumen des Körpers konstant gehalten wird. Dies ist wichtig, da sonst die Druckarbeit in der Energiebilanz mit berücksichtigt werden müsste. Die Einheit der Wärmekapazität ist
![J
[CV ] = ---
K](td-201576x.png) |
Bezieht man die Wärmekapazität auf die Masse M des Körpers, so spricht man von der spezifischen Wärmekapazität cV
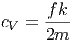 | (2.16) |
Die Einheit der spezifischen Wärmekapazität ist
![J m2
[cV] = ----- = -2---
kgK s K](td-201578x.png) |
In der Thermodynamik ist es üblich, mit molaren Grössen zu rechnen. Die Avogadro-Zahl
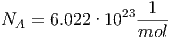 | (2.17) |
gibt an, wie viele Teilchen in einem mol drin sind. Ein mol ist die Anzahl Atome des Isotops 12C, die in 0.012kg dieser Substanz drin ist. 12C selber hat per Definition das Atomgewicht 12u. Die Einheit
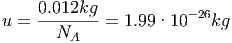 |
Die molare Wärmekapazität bei konstantem Volumen ist dann
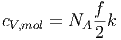 | (2.18) |
Bei einem Festkörper ist die Anzahl Freiheitsgrade f = 6. Dann ist
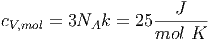 | (2.19) |
Diese Gleichung ist bekannt unter dem Namen Gesetz von Dulong-Petit.
Bei Gasen unterscheidet man die Wärmekapazität bei konstantem Volumen CV und die Wärmekapazität bei konstantem Druck Cp. Cp unterscheidetr sich von CV , da sie die Kompressionsarbeit enthält.
| In der Regel sind sowohl CV (T) und Cp(T)
wie auch die davon abgeleiteten molaren und
spezifischen Wärmekapazitäten Funktionen der
Temperatur T. |
 Lizenzinformationen
Lizenzinformationen