Weiter: Wärmekapazität bei konstantem Druck Oben: Wärmelehre Zurück: Kinetische Gastheorie Skript: PDF-Datei Übungen: Blätter
| Dieser Stoff wurde am 14. 05. 2007 behandelt |
|
|
Materialien
Folien zur Vorlesung am 14. 05. 2007 PDF |
![\includegraphics[width=0.5\textwidth]{hauptsatz_eins-007}](img1144.gif)
Mechanische Arbeit und Wärmezufuhr erhöhen die innere Energie
|
Die zur Temperatur proportionale Energie wird in der Regel innere
Energie ![]() genannt. Für ein ideales Gas ist die innere Energie
genannt. Für ein ideales Gas ist die innere Energie ![]() proportional zur kinetischen Energie
proportional zur kinetischen Energie ![]() .
.
Die innere Energie kann um ![]() geändert werden, indem die Wärmemenge
geändert werden, indem die Wärmemenge ![]() zugeführt oder indem die mechanische Arbeit
zugeführt oder indem die mechanische Arbeit ![]() an dem System
geleistet wird.
an dem System
geleistet wird.
|
|
Bemerkung zur Notation:
In der Wärmelehre (Thermodynamik unterscheidet man bei differentiellen Grössen, ob es Differentiale von Zustandsfunktionen sind (z. B. |
Andererseits kann die Änderung der inneren Energie über die Wärmekapazität ausgedrückt werden.
Bei Gasen kann die mechanische Arbeit einfach spezifiziert werden
| (4.314) |
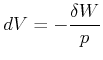 |
Der erste Hauptsatz heisst also auch
| (4.315) |
| (4.316) |
Bei einem idealen Gas erhält man auch
| (4.317) |
Othmar Marti