Weiter: Maxwell-Verteilung Oben: Wärmelehre Zurück: Der erste Hauptsatz Skript: PDF-Datei Übungen: Blätter
Aus dem idealen Gasgesetz (Gleichung (4.29) ) folgt bei konstantem Druck ![]() und Teilchenzahl
und Teilchenzahl ![]() , dass
, dass
Der erste Hauptsatz (Gleichung (4.35) ) besagt, dass
Setzen wir die Definition für die Wärmekapazität bei konstantem Volumen (Gleichung (4.18) ) und das ideale Gasgesetz ein, so erhalten wir
Andererseits ist die Wärmezufuhr pro Mol bei konstantem Volumen gegeben durch
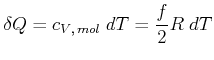 |
Also erhält man pro Mol
![$\displaystyle c_{p\text{,} mol}\; dT = \left[c_{V\text{,} mol}+R\right]\;dT =\left( \frac{f}{2}+1\right)R\; dT$](img1165.gif) |
Aus den Zeiten vor dem SI-System kennt man das Wärmeäquivalent
Bei schnellen Zustandsänderungen in Gasen (zum Beispiel bei Schallwellen) kann ein thermodynamisches System sich nicht mit der Umgebung durch Wärmeaustausch ins Gleichgewicht bringen. Für diese adiabatischen Zustandsänderungen gilt
Wir erhalten aus der idealen Gasgleichung (Gleichung (4.29) )
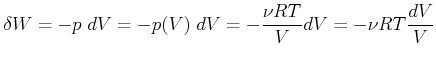 |
Die Wärmezufuhr wird durch
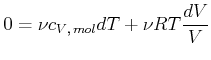 |
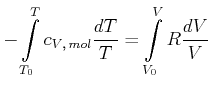 |
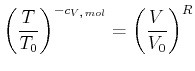 |
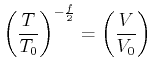 |
(4.321) |
Wir definieren nun den Adiabatenexponenten
Umgeschrieben lautet die Gleichung
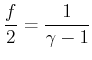 |
Damit bekommen wir die Gleichung
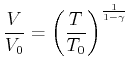 |
(4.323) |
oder, umgekehrt
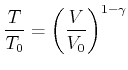 |
(4.324) |
Aus der Gleichung (4.29) für das ideale Gas folgt
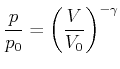 |
(4.325) |
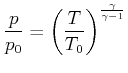 |
(4.326) |
Da bei einem Adiabatischen Prozess wie der Schallausbreitung in der Atmosphäre keine Energie ausgetauscht wird, gilt
| Die ideale Gasgleichung gilt nur bei quasistatischen Prozessen mit Energieaustausch, nicht aber bei adiabatischen Prozessen (d. h., bei Prozessen ohne Energieaustausch. |
Prozesse werden mit Zustandsdiagrammen beschrieben:
![\includegraphics[width=0.7\textwidth]{zustand}](img1195.gif)
Zustandsdiagramm
|
Adiabatische Prozesse nähern sich mit höheren Freiheitsgraden den isothermen Prozessen an.
![\includegraphics[width=0.7\textwidth]{zustand2}](img1196.gif)
Doppelt logarithmische Darstellung des Zustandsdiagramms
|
![\includegraphics[width=0.7\textwidth]{zustand1}](img1197.gif)
Darstellung der häufigsten Typen von Zustandsänderungen
|
|
Die Druckarbeit bei den verschiedenen Zustandsänderungen hat jeweils die folgende Grösse:
|
Othmar Marti