Weiter: Begriffe Oben: Wärmelehre Zurück: Osmose Skript: PDF-Datei Übungen: Blätter
Wir betrachten Mischungen bei konstantem Druck. Zwei Stoffe mit den Teilchenzahlen ![]() und
und ![]() sollen
gemischt werden, wobei die beiden Stoffe nicht reagieren sollen. Es gilt also
sollen
gemischt werden, wobei die beiden Stoffe nicht reagieren sollen. Es gilt also
Wir definieren die Molenbrüche
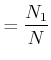 |
||
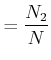 |
(4.702) |
![\includegraphics[width=0.5\textwidth]{thermodynamik-181}](img2699.gif)
|
Abbildung 4.70 zeigt den Verlauf der freien Enthalpie für mehrere Temperaturen. Im Gleichgewicht ist
![]() minimal. In unserer Abbildung bedeutet dies, dass die Minima die bevorzugten Zustände sind. Zur Bestimmung des
Gleichgewichtes sind die folgenden Bedingungen notwendig und hinreichend:
minimal. In unserer Abbildung bedeutet dies, dass die Minima die bevorzugten Zustände sind. Zur Bestimmung des
Gleichgewichtes sind die folgenden Bedingungen notwendig und hinreichend:
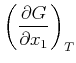 |
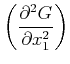 |
Minimum | (4.703) | |||
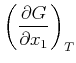 |
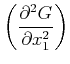 |
Maximum | (4.704) |
Damit wir eine stabile Gleichgewichtslage haben, muss offensichtlich
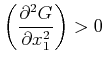 |
![\includegraphics[width=0.45\textwidth]{thermodynamik-182}](img2705.gif)
|
Abbildung 4.71 zeigt die Bereiche, in denen
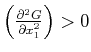 gilt. Mischungen sind nur in diesen Bereichen stabil. Ausserhalb trennen sie sich in zwei
(oder mehrere) Phasen auf. Man nennt den Vorgang Entmischung.
gilt. Mischungen sind nur in diesen Bereichen stabil. Ausserhalb trennen sie sich in zwei
(oder mehrere) Phasen auf. Man nennt den Vorgang Entmischung.
![\includegraphics[width=0.45\textwidth]{thermodynamik-183}](img2707.gif)
![\includegraphics[width=0.45\textwidth]{thermodynamik-184}](img2708.gif)
|
Abbildung 4.72 zeigt, dass es zwischen den instabilen und den Stabilen Bereichen noch metastabile
Bereiche sind. Metastabile Bereiche sind Bereiche, die bei sehr kleinen Störungen stabil, bei grösseren Störungen
jedoch instabil sind. Bei einer Umgebungsbedingung ist ![]() fix. Die horizontale Gerade zeigt für ein
fix. Die horizontale Gerade zeigt für ein ![]() , wie sich
das System als Funktion von
, wie sich
das System als Funktion von ![]() positioniert. Die Punkte mit
positioniert. Die Punkte mit ![]() zeigen zwei koexistierende stabile
Phasen. Der Punkt mit
zeigen zwei koexistierende stabile
Phasen. Der Punkt mit ![]() zeigt eine instabile Phase.
zeigt eine instabile Phase.
![\includegraphics[width=0.7\textwidth]{thermodynamik-185}](img2712.gif)
|
Wenn wie in Abbildung 4.73 zwei Phasen bei ![]() und
und ![]() koexistieren und das System eine Mischung mit
koexistieren und das System eine Mischung mit
![]() darstellt, kann mit dem Hebelgesetz die Zusammensetzung bestimmt werden.
darstellt, kann mit dem Hebelgesetz die Zusammensetzung bestimmt werden.
In diesem Beispiel wollen wir annehmen, dass wir eine Mischung aus der Flüssigphase und der Gasphase haben. Die
Konzentration der Gasphase sei ![]() , die der Flüssigphase
, die der Flüssigphase ![]() . Vom Stoff
. Vom Stoff ![]() gibt es
gibt es
![]() Moleküle, vom Stoff
Moleküle, vom Stoff ![]()
![]() . Insgesamt seien
. Insgesamt seien ![]() Moleküle in der Gaspahse, von beiden
Komponenten eine noch unbekannte Anzahl. Ebenso seinen insgesamt
Moleküle in der Gaspahse, von beiden
Komponenten eine noch unbekannte Anzahl. Ebenso seinen insgesamt ![]() Moleküle in der Flüssigphase. Die Summe
aller Moleküle ist konstant, also
Moleküle in der Flüssigphase. Die Summe
aller Moleküle ist konstant, also
| Gasphase | Flüssigphase | |
| Stoff |
|
|
| Stoff |
|
|
Die Gesamtmenge aller Stoffe ist erhalten (Stofferhaltung). Dies führt zu
| (4.705) |
![\includegraphics[width=0.4\textwidth]{thermodynamik-186}](img2737.gif)
|
Abbildung 4.74 zeigt das Phasendiagramm der flüssigen und gasförmigen Phase zweier Substanzen, die beliebig mischbar sind. Die untere Phasenlinie heisst Siedekurve (Bei Annäherung von tiefen Temperaturen beginnt bei Erreichen der Kurve das Sieden), die obere Kondensationskurve (Bei Annäherung von hohen Temperaturen beginnt bei Erreichen der Kurve die Kondensation). Beim Erwärmen über die Siedetemperatur geschieht folgendes:
Bemerkung:
Wird das Verdampfungsexperiment mit einem offenen Gefäss durchgeführt, reduziert sich die Konzentration der
Gasphase durch Diffusion. Deshalb verschwindet die Flüssigphase erst bei ![]() .
.
![\includegraphics[width=0.4\textwidth]{thermodynamik-187}](img2740.gif)
|
Abbildung 4.75 zeigt das Phasendiagramm beliebig mischbarer Flüssigkeiten mit einem azeotropen
Punkt ![]() . Bei
. Bei ![]() ist die Siedetemperatur maximal. Eine Mischung mit dem Mischungsverhältnis
ist die Siedetemperatur maximal. Eine Mischung mit dem Mischungsverhältnis ![]() heisst
azeotrop. Der Siedevorgang kann sowohl bei reinen Phasen wie auch in
heisst
azeotrop. Der Siedevorgang kann sowohl bei reinen Phasen wie auch in ![]() enden.
enden.
Bemerkung:
Das Wasser-Alkohol-Gemisch ist azeotrop. Bei 96 % Alkohol ist die Siedetemperatur maximal. Deshalb kann man die Alkoholkonzentratin beim Destilieren nicht über diese Grenze erhöhen.
![\includegraphics[width=0.4\textwidth]{thermodynamik-188}](img2743.gif)
|
Wenn bei dem Phasendiagramm aus Abbildung 4.76 eine Flüssigkeit entlang des schwarzen Weges erwärmt
wird, beginnt sie bei ![]() zu sieden. Der Anteil der Gasphase und der Flüssigkeit wird mit dem Hebelgesetz gegeben.
Nach Einsetzen des Sieden nimmt das Gasvolumen zuerst zu, dann (über dem Punkt
zu sieden. Der Anteil der Gasphase und der Flüssigkeit wird mit dem Hebelgesetz gegeben.
Nach Einsetzen des Sieden nimmt das Gasvolumen zuerst zu, dann (über dem Punkt ![]() ) wieder ab. Bei
) wieder ab. Bei ![]() ist die
Flüssigkeit wieder homogen (rückläufige Kondensation).
ist die
Flüssigkeit wieder homogen (rückläufige Kondensation).
![\includegraphics[width=0.4\textwidth]{thermodynamik-189}](img2744.gif)
|
Substanzen mit einem Phasendiagramm wie in Abbildung 4.77 haben eine Mischungslücke. Wenn
die Temperatur über der kritischen Temperatur ![]() liegt, sind die beiden Substanzen in jedem Verhältnis
mischbar. Unter
liegt, sind die beiden Substanzen in jedem Verhältnis
mischbar. Unter ![]() sind nur die Mischverhältnisse links und rechts der Mischungslücke realisierbar.
sind nur die Mischverhältnisse links und rechts der Mischungslücke realisierbar.
![\includegraphics[width=0.4\textwidth]{thermodynamik-190}](img2745.gif)
|
Wenn die Substanz in der Abbildung 4.78 abgekühlt wird, trifft sie bei ![]() auf die Phasengrenze der
Mischungslücke. Nach dem Hebelgesetz spaltet sie sich in zwei Substanzen mit unterschiedlicher Konzentration auf
(
auf die Phasengrenze der
Mischungslücke. Nach dem Hebelgesetz spaltet sie sich in zwei Substanzen mit unterschiedlicher Konzentration auf
(![]() und
und ![]() ). Die eine Substanz kühlt entlang der Linie
). Die eine Substanz kühlt entlang der Linie ![]() , die andere entlang der Linie
, die andere entlang der Linie ![]() .
.
Neben der in Abbildung 4.77 gezeigten Mischungslücke sind (mindestens) zwei weitere Arten möglich.
![\includegraphics[width=0.4\textwidth]{thermodynamik-191}](img2748.gif)
![\includegraphics[width=0.4\textwidth]{thermodynamik-192}](img2749.gif)
Links: Mischungslücke bei hohen Temperaturen, Rechts Mischungslücke in einem begrenzten Temperaturbereich
(Bsp: Nikotin).
|
![\includegraphics[width=0.4\textwidth]{thermodynamik-193}](img2750.gif)
|
![\includegraphics[width=0.4\textwidth]{thermodynamik-194}](img2751.gif)
![\includegraphics[width=0.4\textwidth]{thermodynamik-195}](img2752.gif)
|
Abbildung 4.81 zeigt zwei Wege durch das Phasendiagramm. Wir betrachten das linke Diagramm. Wird
die Mischung mit dem Mischungsverhältnis
![]() abgekühlt, trifft sie bei
abgekühlt, trifft sie bei ![]() auf die Phasengrenze.
Die flüssige Mischung trennt sich in zwei Komponenten auf. Auf dem linken Ast
auf die Phasengrenze.
Die flüssige Mischung trennt sich in zwei Komponenten auf. Auf dem linken Ast ![]() wird die flüssige Komponente
mit abnehmendem
wird die flüssige Komponente
mit abnehmendem ![]() abgekühlt, Auf dem rechten Ast
abgekühlt, Auf dem rechten Ast ![]() wird die feste Komponente abgekühlt. Der Anteil der beiden
Phasen ergibt sich durch das Hebelgesetz. Bei
wird die feste Komponente abgekühlt. Der Anteil der beiden
Phasen ergibt sich durch das Hebelgesetz. Bei ![]() hat die feste Phase die gleiche Zusammensetzung wie die
Flüssigkeit am Anfang. Die Flüssige Phase verschwindet deshalb bei
hat die feste Phase die gleiche Zusammensetzung wie die
Flüssigkeit am Anfang. Die Flüssige Phase verschwindet deshalb bei ![]() . Das Weitere Abkühlen lässt die nun feste
Phase bei
. Das Weitere Abkühlen lässt die nun feste
Phase bei ![]() wieder auf eine Phasengrenze treffen. Auch wenn die Mischung fest ist, heisst das nicht, dass Atome
sich nicht bewegen können. Lokal, in kleinen Bereichen, ergibt sich eine Phasentrennung. Die beiden Phasen bewegen
sich entlang der Linien
wieder auf eine Phasengrenze treffen. Auch wenn die Mischung fest ist, heisst das nicht, dass Atome
sich nicht bewegen können. Lokal, in kleinen Bereichen, ergibt sich eine Phasentrennung. Die beiden Phasen bewegen
sich entlang der Linien ![]() sowie
sowie ![]() . Wieder wird der Anteil der beiden Phasen durch das Hebelgesetz gegeben.
. Wieder wird der Anteil der beiden Phasen durch das Hebelgesetz gegeben.
Im rechten Diagramm in der Abbildung 4.81 betrachten wir ein anderes Mischungsverhältnis
![]() mit kleinerem
mit kleinerem ![]() . Die Mischung wird abgekühlt und trifft bei
. Die Mischung wird abgekühlt und trifft bei ![]() auf eine Phasengrenze. Sie
teilt sich in einen festen Anteil bei
auf eine Phasengrenze. Sie
teilt sich in einen festen Anteil bei ![]() und einen flüssigen Anteil bei
und einen flüssigen Anteil bei ![]() auf. Die flüssige Phase kühlt sich
weiter ab und trifft bei
auf. Die flüssige Phase kühlt sich
weiter ab und trifft bei ![]() auf den eutektischen Punkt. Die linke Phase ist hat sich dabei entlang
auf den eutektischen Punkt. Die linke Phase ist hat sich dabei entlang ![]() abgekühlt. Die Anteile ergeben sich aus dem Hebelgesetz. Am eutektischen Punkt erstarrt die Flüssigkeit
schlagartig. Es gibt keine Entmischung und das Eutektikum bleibt auch bei tieferen Temperaturen erhalten. Die
Feste Phase bei
abgekühlt. Die Anteile ergeben sich aus dem Hebelgesetz. Am eutektischen Punkt erstarrt die Flüssigkeit
schlagartig. Es gibt keine Entmischung und das Eutektikum bleibt auch bei tieferen Temperaturen erhalten. Die
Feste Phase bei ![]() wird weiter abgekühlt nach
wird weiter abgekühlt nach ![]() . Lokal tritt Phasentrennung auf zu der Phase entlang der Linie
. Lokal tritt Phasentrennung auf zu der Phase entlang der Linie
![]() . Die Anteile dieser Phasen müssen wieder mit dem Hebelgesetz berechnet werden.
. Die Anteile dieser Phasen müssen wieder mit dem Hebelgesetz berechnet werden.
![\includegraphics[width=0.4\textwidth]{thermodynamik-196}](img2759.gif)
Alternative Lage der Grenzlinien (Vergleich zu Abbildung 4.80)
|
Hier ist
Bemerkung:
![]() kann in der Temperatur nicht höher liegen als
kann in der Temperatur nicht höher liegen als ![]() oder
oder ![]() .
.
![\includegraphics[width=0.4\textwidth]{thermodynamik-197}](img2760.gif)
Phasendiagramm mit unmischbarer fester Phase
|
![\includegraphics[width=0.4\textwidth]{thermodynamik-198}](img2761.gif)
Phasendiagramm mit chemischer Verbindung
|
Bei diesem Diagramm sollen zwei Substanzen im flüssigen Zustand beliebig mischbar sein. Im festen Zustand sind sie nicht mischbar, gehen aber eine chemische Verbindung ein.
![\includegraphics[width=0.4\textwidth]{thermodynamik-199}](img2762.gif)
Phasendiagramm mit 2 Tripelpunkten
|
Dieses Diagramm hat zwei Tripelpunkte
Othmar Marti