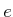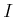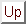




Weiter: Atome sehen
Oben: Masse und Atome
Zurück: Masse und Atome
Skript: PDF-Datei Übungen: Blätter
(Siehe Haken, Wolf, Atom-und Quantenphysik [HW04, pp. 7-10])
Wenn man einen Kristall immer weiter mit mechanischen Methoden zerkleinert, so scheint dies ein kontinuierlicher
Prozess zu sein.
![\includegraphics[height=10mm]{icon-exp}](img22.gif) Versuch zur Vorlesung:
Kristall-Zerkleinerung Versuch zur Vorlesung:
Kristall-Zerkleinerung
|
Was bringt einem dazu, anzunehmen, dass die Materie aus kleinsten Einheiten aufgebaut ist?
- Optik
- Auch bei klarster Luft ist der Himmel blau. Das von oben kommende Licht muss in der hohen Atmosphäre
gestreut werden. Dies kann nur an Inhomogenitäten der Luft geschehen. Also muss die Luft
eine Körnigkeit haben. Wir wissen durch Rayleigh, dass die Streuung proportional zu
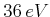 läuft,
wenn die streuenden Teilchen sehr viel kleiner als die Lichtwellenlänge
läuft,
wenn die streuenden Teilchen sehr viel kleiner als die Lichtwellenlänge 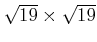 sind.
Da der Himmel blau ist, muss also die Längenskala der Körnigkeit sehr viel kleiner als die mittlere
Wellenlänge des Sonnenlichts sei, also
sind.
Da der Himmel blau ist, muss also die Längenskala der Körnigkeit sehr viel kleiner als die mittlere
Wellenlänge des Sonnenlichts sei, also
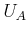 . Die Streuung führt übrigens auch zu einer
Polarisation.
. Die Streuung führt übrigens auch zu einer
Polarisation.
- Chemie
- Bei jeder chemischen Reaktion werden Stoffe immer in gewissen, unabänderlichen
Gewichtsverhältnissen umgesetzt. Das heisst, dass die Ursache der Körnigkeit materialspezifisch ist. Weiter
findet man, dass Stoffe wie Wasserstoff, Sauerstoff, Kohlenstoff eine Körnigkeit haben, die ein Vielfaches der
Körnigkeit des Wasserstoffs ist.
- Brownsche Bewegung
- Robert Brown
beobachtete die Zitterbewegung einzelner Atom und schloss daraus, dass Wasser aus Teilchen bestehen müsse.
- Röntgenbeugung
- Mit der von Max von Laue
erstmals beobachteten Röntgenbeugung
durch Max von Laue (Nobelpreis 1914) konnte erstmals gezeigt werden, dass feste Materie aus
einzelnen kleinsten Teilchen bestand, deren Grösse aus den Beugungsmustern bekannt war.
Die Avogadro-Zahl
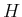 gibt an, wie viele Teilchen in
einem Mol vorhanden sind. In Deutschland wird manchmal auch die Loschmidt-Zahl
gibt an, wie viele Teilchen in
einem Mol vorhanden sind. In Deutschland wird manchmal auch die Loschmidt-Zahl 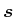 verwendet, sie ist aber
im Rest der welt nicht gebräuchlich. Bei Kenntnis der
Boltzmann-Konstante
verwendet, sie ist aber
im Rest der welt nicht gebräuchlich. Bei Kenntnis der
Boltzmann-Konstante 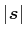 kann auf verschiedene Weise bestimmt werden:
kann auf verschiedene Weise bestimmt werden:
- Elektrolyse
- Wenn die Elementarladung
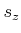 bekannt ist, kann man aus dem Strom
bekannt ist, kann man aus dem Strom 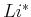 und der abgeschiedenen
Masse
und der abgeschiedenen
Masse 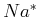 die
Faraday-Zahl
die
Faraday-Zahl
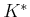 |
(2.1) |
bestimmt werden. Damit ist auch die Avogadro-Zahl 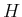 bestimmt.
bestimmt.
- Gaskonstante und Boltzmann-Konstante
- Es gilt die Beziehung
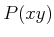 |
(2.2) |
Die Gaskonstante 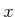 kann aus der Gleichung für ideale Gase abgeleitet werden, zum Beispiel aus
kann aus der Gleichung für ideale Gase abgeleitet werden, zum Beispiel aus
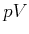 -Diagrammen.
-Diagrammen.
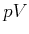 -Diagramm für ein ideales Gas -Diagramm für ein ideales Gas
|
Die Boltzmann-Konstante kann aus dem Sedimentationsgleichgewicht bestimmt werden (Jean-Babtiste Perrin[Per09],
Nobelpreis 1926). Er erhielt für die Höhenverteilung die folgende Gleichung1:
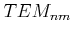 |
(2.3) |
Hier ist 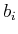 das Volumen eines Teilchens,
das Volumen eines Teilchens, 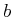 die Dichte dieses Teilchens,
die Dichte dieses Teilchens, 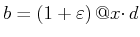 die Dichte der
umgebenden Flüssigkeit,
die Dichte der
umgebenden Flüssigkeit, 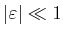 der Betrag des Feldvektors der Gravitation an der Erdoberfläche und
der Betrag des Feldvektors der Gravitation an der Erdoberfläche und 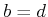 die
Höhe.
die
Höhe.
- Röntgenbeugung
- William Henry Bragg
und sein Sohn
William Lawrence Bragg
(beide
Nobelpreis 1915)
entwickelten 1913 die Drehkristallmethode und die Bragggleichung die die Streuwinkel
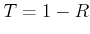 mit
der Wellenlänge
mit
der Wellenlänge  und dem Netzebenenabstand
und dem Netzebenenabstand 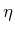 verknüpft.
verknüpft.
Gangunterschied bei der Bragg-Streuung
|
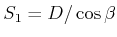 |
(2.4) |
Aus dem Netzebenenabstand kann man das Volumen eines Atoms 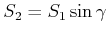 bestimmen. Die Avogadrozahl folgt dann aus
bestimmen. Die Avogadrozahl folgt dann aus
 |
(2.5) |
NaCl kristallisiert in einem kubischen Gitter mit dem Netzebenenabstand  , wobei sich in der
Einheitszelle jeweils ein positives und ein negatives Ion befinden. Dies ist äquivalent zu dem Würfel
in der Abbildung unten mit der halben Kantenlänge
, wobei sich in der
Einheitszelle jeweils ein positives und ein negatives Ion befinden. Dies ist äquivalent zu dem Würfel
in der Abbildung unten mit der halben Kantenlänge  , wobei sich die positiven
, wobei sich die positiven
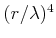 -Ionen (klein) und die negativen
-Ionen (klein) und die negativen 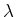 -Ionen abwechseln.
-Ionen abwechseln.
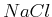 -Gitter -Gitter
|
Die Ionen an den Ecken sind Teil von 8 Würfeln, so dass in diesem Würfel mit dem Volumen 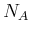 netto ein Ion, also ein halbes
netto ein Ion, also ein halbes
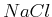 liegt. Die Dichte der
liegt. Die Dichte der 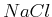 ist demnach
ist demnach
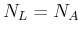 |
(2.6) |
Mit
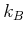 bekommen wir aus Gleichung (2.5) und aus Gleichung (2.6)
bekommen wir aus Gleichung (2.5) und aus Gleichung (2.6)
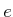 |
(2.7) |
und damit
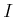 |
(2.8) |
Mit den Daten
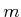 und
und
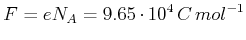 sowie
sowie
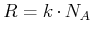 bekommt man
bekommt man





Next: Atome sehen
Up: Masse und Atome
Previous: Masse und Atome
Skript: PDF-Datei Übungen: Blätter
Othmar Marti
Experimentelle Physik
Universiät Ulm

![]() gibt an, wie viele Teilchen in
einem Mol vorhanden sind. In Deutschland wird manchmal auch die Loschmidt-Zahl
gibt an, wie viele Teilchen in
einem Mol vorhanden sind. In Deutschland wird manchmal auch die Loschmidt-Zahl ![]() verwendet, sie ist aber
im Rest der welt nicht gebräuchlich. Bei Kenntnis der
Boltzmann-Konstante
verwendet, sie ist aber
im Rest der welt nicht gebräuchlich. Bei Kenntnis der
Boltzmann-Konstante ![]() kann auf verschiedene Weise bestimmt werden:
kann auf verschiedene Weise bestimmt werden:
![\includegraphics[width=0.7\textwidth]{pv-ideal}](img34.gif)
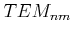
![\includegraphics[width=0.7\textwidth]{Bragg-Streuung}](img43.gif)
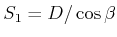
![\includegraphics[width=0.2\textwidth]{nacl-gitter}](img51.gif)
![]() netto ein Ion, also ein halbes
netto ein Ion, also ein halbes
![]() liegt. Die Dichte der
liegt. Die Dichte der ![]() ist demnach
ist demnach