Weiter: Extensive und intensive Variablen Oben: Wärmelehre Zurück: Anwendung auf das ideale Skript: PDF-Datei Übungen: Blätter
![\includegraphics[width=0.7\textwidth]{hauptsatz_drei-004}](img1958.gif)
System aus zwei Molekülsorten
|
Wir betrachten nun ein Gesamtsystem, bei dem zu Beginn zwei Molekülsorten ![]() und
und ![]() in zwei getrennten
Kompartimenten mit den Volumina
in zwei getrennten
Kompartimenten mit den Volumina ![]() und
und ![]() befinden. Es gibt jeweils
befinden. Es gibt jeweils ![]() und
und ![]() Teilchen von der
jeweiligen Sorte. Die Grösse des Gesamtvolumens
Teilchen von der
jeweiligen Sorte. Die Grösse des Gesamtvolumens ![]() sowie die gesamte Teilchenzahl
sowie die gesamte Teilchenzahl ![]() sollen
konstant sein6. Die
Trennwand zwischen den beiden Kompartimenten sei beweglich, so dass sowohl die Temperatur
sollen
konstant sein6. Die
Trennwand zwischen den beiden Kompartimenten sei beweglich, so dass sowohl die Temperatur ![]() wie auch der Druck
wie auch der Druck
![]() konstant sind. Wir hatten früher die Mischung von identischen Teilchen betrachtet oder das Ausströmen von
Teilchen ins andere Teilvolumen betrachtet. Hier versuchen wir zum ersten mal, die Eigenschaften eines Gemisches
mit zwei Teilchensorten zu verstehen.
konstant sind. Wir hatten früher die Mischung von identischen Teilchen betrachtet oder das Ausströmen von
Teilchen ins andere Teilvolumen betrachtet. Hier versuchen wir zum ersten mal, die Eigenschaften eines Gemisches
mit zwei Teilchensorten zu verstehen.
Beide Moleküle sollen ideale Gase sein. Aus der idealen Gasgleichung wissen wir, dass ![]() sein muss. bei
gleicher Temperatur
sein muss. bei
gleicher Temperatur ![]() und gleichem Druck
und gleichem Druck ![]() folgt
folgt
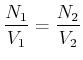 |
Wenn sich nach der Mischung alle Moleküle vom Typ ![]() im linken Kompartiment
im linken Kompartiment ![]() mit
mit ![]() befinden, ist die
Entropie um
befinden, ist die
Entropie um
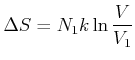 |
Mit
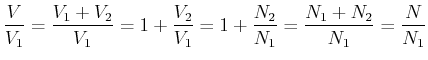 |
Also können wir die Entropiedifferenz auch mit den Teilchenzahlen schreiben.
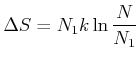 |
(4.476) |
Die Mischungsentropie ist die Summe aus den Entropieänderungen wenn sich jeweils die Molekülsorte ![]() in
in
![]() und
und ![]() in
in ![]() befinden.
befinden.
Mischungsentropie
|
Beispiel:
Wir mischen zwei Molekülsorten mit gleichen Anteilen. Sei
![]() . Beispielsweise könnten wir He und
Ne mischen.
. Beispielsweise könnten wir He und
Ne mischen.
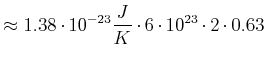 |
||
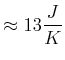 |
(4.478) |
Beispiel:
Silizium soll mit ![]() (1 part per million) verunreinigt sein. Wir wollen die Mischungsentropie für
(1 part per million) verunreinigt sein. Wir wollen die Mischungsentropie für ![]() Si
berechnen
Si
berechnen
Sie ist
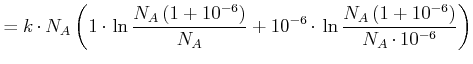 |
||
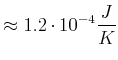 |
(4.479) |
Wir wenden hier die Methode nach dem dritten Hauptsatz an. Wir wollen die Differenz der Entropie einer Legierung vor und nach dem Vorgang bestimmen. Für reversible Vorgänge (immer im Gleichgewicht) gilt
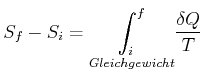 |
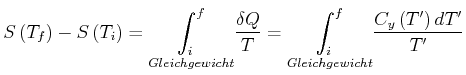 |
(4.480) |
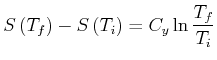 |
(4.481) |
Wir wollen nun das praktische Beispiel berechnen, wie gross die Entropiezunahme bei der chemischen Verbindung
![]() ist. Wir nehmen dazu an, dass wir für
ist. Wir nehmen dazu an, dass wir für ![]() ,
, ![]() und
und ![]() die Wärmekapazitäten
die Wärmekapazitäten
![]() ,
,
![]() und
und
![]() kennen. Nach dem dritten Hauptsatz ist geht die Entropie bei
kennen. Nach dem dritten Hauptsatz ist geht die Entropie bei
![]() zu einem festen Wert
zu einem festen Wert ![]() ,
unabhängig von der genauen Anfangskonfiguration und den Systemparametern. Wir können also schreiben
,
unabhängig von der genauen Anfangskonfiguration und den Systemparametern. Wir können also schreiben
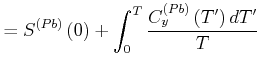 |
||
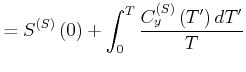 |
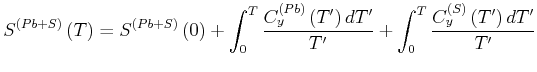 |
(4.483) |
Die Entropiegleichung gilt natürlich auch für die Verbindung
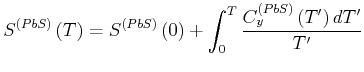 |
Die Gleichung (4.208) erlaubt uns nun, die benötigte Energie zur
Dissoziation ![]() in
in ![]() und
und ![]() vorherzusagen. Dazu braucht man nur die
Wärmekapazitätend
vorherzusagen. Dazu braucht man nur die
Wärmekapazitätend ![]() der beteiligten Stoffe zu kennen. Das Verfahren kann auf alle Verbindungen angewendet
werden. Es zeigt, ob eine Verbindung stabil ist.
der beteiligten Stoffe zu kennen. Das Verfahren kann auf alle Verbindungen angewendet
werden. Es zeigt, ob eine Verbindung stabil ist.
Othmar Marti