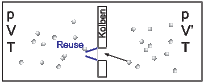
Reusenmaschine (analog zur Fischreuse)

Im ersten Hauptsatz haben wir die Konsequenzen der Energieerhaltung untersucht. Hier wollen wir nun die Eigenschaften kontinuierlich laufender Maschinen untersuchen.
| Jede kontinuierlich laufende Maschine muss
periodisch oder zyklisch sein. Diese Prozesse
heissen Kreisprozesse. |
| Der 2. Hauptsatz: Es gibt keine zyklische
Maschine, die nur einem Wärmebad Energie
entzieht und in mechanische Arbeit umwandelt. |

Reusenmaschine (analog zur Fischreuse)
Die Reusenklappen sollen so weich gelagert sein, dass ein Molekül, das von rechts kommt, sie aufstossen kann. Dadurch können zwar Moleküle von rechts nach links, nicht aber von links nach rechts gelangen. Der Druck (bei konstanter Temperatur) erhöht sich links, und der Kolben wird nach rechts bewegt, leistet also Arbeit. Wenn aber ein Molekül die Reusenklappen öffnen kann, bedeutet dies, dass Brownsche Bewegung (wegen der Temperatur der Reusenklappen) diese auch öffnen kann. Man könnte die Reusenklappen kühlen, dann hätte man aber zwei Wärmebäder.
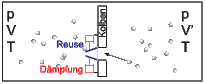
Reusenmaschine mit Dämpfung
Hier gilt das gleiche: Die Dämpfung ist nur effektiv, wenn der Stossdämpfer gekühlt wird T2 < T. Dann hat man aber 2 Wärmereservoirs. Bei einer elektrischen Dämpfung (Wirbelstrombremse) bringt das Widerstandsrauschen die Klappen zum Schwingen. Dies funktioniert also auch nicht.

Ratschenmaschine nach Feynman
Die Brownsche Bewegung dreht die Maschine. Die Klinke bewirkt, dass die Maschine sich nur in eine Richtung bewegen kann. Die Rätschenmaschine ist kein Perpetuum Mobile zweiter Art, da die Ratsche, analog zu oben, so leicht sein muss, dass sie wegen ihrer Brownschen Bewegung ohne Dämpfung hochspringen (elastisch) würde.
| Es ist kein Perpetuum Mobile 2. Art möglich. |
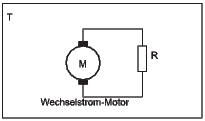
Perpetuum Mobile mit Wechselstrom-Elektromotor
Der verwendete Wechselstrommotor soll ein idealer Motor (ohne Innenwiderstand) sein. Unabhängig von der Richtung und der Grösse der angelegten Spannung soll er sich in die gleiche Richtung drehen. Hier nutzen wir die Rauschspannung am Widerstand R aus. Diese dreht den Motor: ein Perpetuum Mobile der 2. Art.
Auch hier funktioniert das nicht, da der Motor durch die Brownsche Bewegung des Ankers genauso wie der Widerstand eine Rauschspannungsquelle ist. Der Motor wirkt also als Generator. Um eine mechanische Arbeit zu leisten, müsste der Motor gekühlt werden.
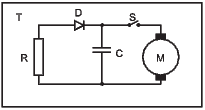
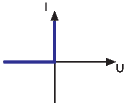
Perpetuum Mobile zweiter Art mit idealer Diode. Rechts ist die Kennlinie einer idealen Diode.
Eine ideale Diode D hat in die eine Polarisationsrichtung den Widerstand null und in die andere den Widerstand unendlich. Hier lädt also die Rauschspannung über die Diode D den Kondensator C auf. Wenn die Spannung gross genug ist, wird C über den Schalter S durch den Motor M entladen. Dieser leistet mechanische Arbeit. Bei dieser Anordnung ist das Zittern des Motors nicht relevant.
Die Anordnung ist trotzdem kein Perpetuum Mobile 2. Art, da, wie in der Festkörperphysik oder der Vorlesung Physikalische Elektronik und Messtechnik gezeigt wird, es keine ideale Diode gibt.
Durch Betrachtung von Wahrscheinlichkeiten kann der Zweite Hauptsatz auf statistische Gesetze zurückgeführt werden.
Dies steht eventuell im Gegensatz zu der Betrachtung, die die Entropie aus der Definition einer Adiabaten abgeleitet hat.
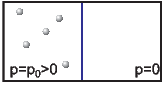
Nach dem Öffnen verteilen sich die Moleküle auf beiden Kästen. Der Umkehrprozess ist nicht beobachtbar.
Wir betrachten drei Teilchen, nummeriert von 1 bis 3, die entweder links oder rechts sind. Jedes Teilchen kann also die Zustände „links“ oder „rechts“ einnehmen.
In der Regel wird das gesamte Volumen so in Kompartimente eingeteilt, dass in jedem Kompartiment nur keines oder ein Molekül ist.
Die räumliche Ausdehnung von Mikrozuständen ist klein gegen die des gesamten Systems. Sie muss jedoch gross gegen die charakteristische Strukturlänge der Teilchen sein. Bei Helium zum Beispiel werden die Atome bezüglich der Mikrozustände als Punkte angesehen.
Die Konsequenz dieser Aussagen ist, dass die Betrachtung nur gilt, wenn die charakteristischen Längen ≥ 1μm sind.
Zwischen der atomaren Betrachtung und der makroskopischen Physik, also bei Längenskalen von Nanometern bis Mikrometern spricht man von der mesoskopischen Physik, einem aktuellen Forschungsgebiet.
| Ein System im Gleichgewicht befindet sich
mit gleicher Wahrscheinlichkeit in jedem ihm
zugänglichen Zustand. |
Die nicht unterscheidbaren Mikrozustände werden zu einem Makrozustand zusammengefasst. Sein statistisches Gewicht entspricht der Anzahl Mikrozustände.
Betrachtet man Makrozustände, sind die einzelnen Teilchen äquivalent oder ununterscheidbar.
| links | rechts |
| 1 | 2,3 |
| 2 | 1,3 |
| 3 | 2,3 |
Die drei Mikrozustände mit einem Teilchen links und zwei Teilchen rechts bilden einen Makrozustand.
| Makrozustand | Gewicht | Anzahl links | Anzahl rechts |
| 1 | 1 | 3 | 0 |
| 2 | 3 | 2 | 1 |
| 3 | 3 | 1 | 2 |
| 4 | 1 | 0 | 3 |
Das Gewicht der einzelnen Makrozustände wird durch die Anzahl der Mikrozustände bestimmt.
Bei insgesamt N Teilchen sind m Teilchen im linken Kompartiment und N -m Teilchen im rechten Kompartiment. Das Statistische Gewicht dieses Zustandes ist
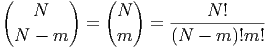 | (2.1) |
Dies ist die Binominalverteilung (Siehe Bronstein, Taschenbuch der Mathematik [BSMM08, pp. 13]) .
| Anzahl Teilchen | Zustand | Gewicht | |
| links | rechts | ||
| 2 | 2 | 0 | 1 |
| 1 | 1 | 2 | |
| 0 | 2 | 1 | |
| 3 | 3 | 0 | 1 |
| 2 | 1 | 3 | |
| 1 | 2 | 3 | |
| 0 | 3 | 1 | |
| 4 | 4 | 0 | 1 |
| 3 | 1 | 4 | |
| 2 | 2 | 6 | |
| 1 | 3 | 4 | |
| 0 | 4 | 1 | |
| usw. | |||
Für gross N geht die Binominalverteilung in die Gaussverteilung über.
Wir betrachten nochmals zwei Teilchen mit den Zuständen „+“ und „-“. Die Teilchen sind mit den Wahrscheinlichkeiten p = 0.5 im Zustand „+“ und mit der Wahrscheinlichkeit q = 1 - p = 0.5 im Zustand „-“.
| Makrozustand | Anzahl Mikrozustände | statistisches Gewicht |
| - - - | 1 | 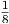 |
| + - - | 3 | 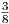 |
| + + - | 3 | 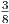 |
| + + + | 1 | 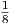 |
| Summe | 8 |
Insgesamt gibt es 8 = 23 Mikrozustände verteilt auf 4 Makrozustände.
Allgemein gibt es bei N Teilchen mit m Teilchen im Zustand „+“ und N - m Teilchen im Zustand „-“
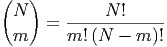 |
Zustände, jeweils mit dem statistischen Gewicht
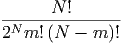 |
Die Gesamtzahl aller Mikrozustände ist 2N.
Wenn man Zahlenwerte einsetzt, sieht man, dass extreme Makrozustände – alle Teilchen im gleichen Zustand – extrem selten sind.
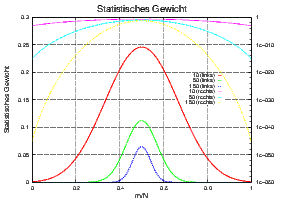
Statistisches Gewicht, oder Wahrscheinlichkeit, für Makrozustände mit m = 0 bis m = 10,50,150 und N = 10,50,150, links lineare Skala und rechts logarithmische Skala. Die extremen Zustände haben Wahrscheinlichkeiten von < 10-40.
Um den Zustand eines Systems anzugeben bestimmt man zuerst seinen Mikrozustand.
Dabei sind die pi’s die zu den Ortskoordinaten xi konjugierten Impulse. Bei kartesischen Koordinaten ohne Magnetfeld und innere Freiheitsgrade gilt pi = mvi. Mit Magnetfeld oder inneren Freiheitsgraden sind die pi auf eine kompliziertere Weise definiert.
Der Vektor
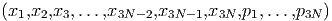 |
beschreibt den Mikrozustand des Systems.
Beispiel: ein Teilchen auf einer Gerade

Ort x und Impuls p eines Teilchens
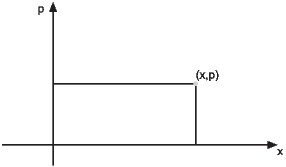
Phasenraum eines Teilchens in einer eindimensionalen Welt.
Um Zustände definieren zu können, unterteilen wir den Phasenraum in Zellen mit den Seiten δx und δp.
Das Phasenraumvolumen ist dann
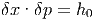 |
mit der Einheit ![[h0 ]](td-2015475x.png) = m·
= m·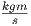 = Js. In der klassischen
Physik (hier) ist h0 eine variable Grösse, die man am Ende jeder
Rechnung gegen null gehen lässt. In der Quantenmechanik
hat das Phasenraumvolumen eines Teilchens in einer
Dimension eine feste Grösse
= Js. In der klassischen
Physik (hier) ist h0 eine variable Grösse, die man am Ende jeder
Rechnung gegen null gehen lässt. In der Quantenmechanik
hat das Phasenraumvolumen eines Teilchens in einer
Dimension eine feste Grösse
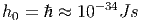 |
Wir zählen nun die Phasenraumzellen ab. Die Koordinaten sagen dann, in welcher Phasenraumzelle ein Teilchen sich gerade aufhält. Deshalb beschreibt ein f = 6N - dimensionaler Vektor den momentanen Zustand eines N-Teilchen-Systems. Man kann auch sagen, ein System aus N Punktteilchen hat f = 6N Freiheitsgrade.
Bemerkung: Die statistische Mechanik und die statistische Interpretation der Quantenmechanik sind sich sehr ähnlich.
Beispiel Überströmversuch mit N Teilchen
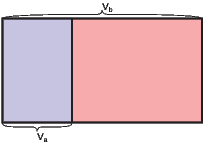
Die Wahrscheinlichkeit, ein Teilchen in V a zu finden ist proportional zum Anteil des Volumens V a am Gesamtvolumen V b.
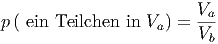 |
Für zwei Teilchen erhält man
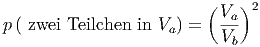 |
Für N Teilchen im Volumen V a bekommt man
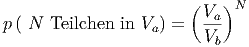 |
Wenn V a = 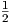 V b und N ~ 1023 Teilchen ist, beträgt die
Wahrscheinlichkeit dass alle Teilchen in V a sind
V b und N ~ 1023 Teilchen ist, beträgt die
Wahrscheinlichkeit dass alle Teilchen in V a sind
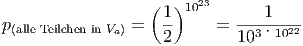 |
Dies ist eine Zahl mit 3·1022 - 1 Nullen zwischen Komma und „3“. Das Universum selber hat etwa 1077 Teilchen (plus minus ein paar Grössenordnungen).
Bemerkung Die statistische Mechanik sagt nichts über die Geschwindigkeit aus, mit der Zustände erreicht werden.
Was meint man mit irreversibel:?
Wir zählen die Anzahl Zustände, die zwischen E und E + δE liegen. In vielen Fällen ist diese Energie die innere Energie U. Um auch die Fälle mitzunehmen, bei denen die Gesamtenergie wesentlich durch andere Energien bestimmt ist, verwenden wir hier den Buchstaben E. Solche Fälle sind, zum Beispiel, die Thermodynamik in starken Lichtfeldern oder in der Nähe eines schwarzen Lochs. Wir nennen diese Anzahl
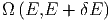 |
Die Grösse δE muss so gewählt werden, dass sie klein gegen
die Energie selber ist, und dass sie gross gegen die internen
Energieskalen (z.B. die Abstände der quantenmechanischen
Energieniveaux) ist. Aus der Anzahl der Zustände definieren
wir die Zustandsdichte ω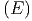 :
:
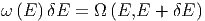 | (2.2) |
Wenn die Zustandsdichte bekannt ist, berechnen sich die Erwartungswerte der Grössen y wie
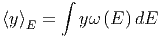 | (2.3) |
Insbesondere ist der Erwartungswert der Energie
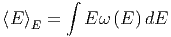 | (2.4) |
Wie gross ist Ω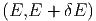 ? Wir nehmen an, dass das
System f Freiheitsgrade hat. Für jeden Freiheitsgrad soll es
ϕ1(ε) ∝ εα Zustände geben. Dabei muss α ≈ 1 sein.
Andererseits fällt auf jeden Freiheitsgrad die Energie
? Wir nehmen an, dass das
System f Freiheitsgrade hat. Für jeden Freiheitsgrad soll es
ϕ1(ε) ∝ εα Zustände geben. Dabei muss α ≈ 1 sein.
Andererseits fällt auf jeden Freiheitsgrad die Energie 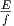 = ε.
Die Gesamtzahl der Zustände ϕ(E) ist dann das Produkt der
Anzahl der einzelnen Zustände.
= ε.
Die Gesamtzahl der Zustände ϕ(E) ist dann das Produkt der
Anzahl der einzelnen Zustände.
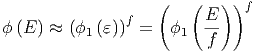 | (2.5) |
Die Anzahl Zustände zwischen E und E + δE, also in einer Kugelschale einer f-dimensionalen Kugel der Dicke δE berechnen2
Ω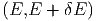 | = ϕ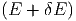 - ϕ - ϕ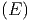 | ||
= 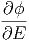 δE δE | |||
≈ fϕ1f-1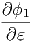 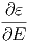 ·δE ·δE | |||
= fϕ1f-1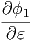 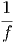 ·δE ·δE | |||
= ϕ1f-1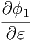 ·δE ·δE | (2.6) |
Die Anzahl Zustände ϕ1 ändert sich langsam mit ε, die
Anzahl der gesamten Zustände nimmt aber, da f sehr
gross ist, extrem schnell zu. Dies gilt im allgemeinen für
Ω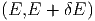 und ω(E) =
und ω(E) = 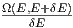 . Logarithmieren wir
Gleichung (2.6) und vernachlässigen konstante oder sich nur
langsam ändernde Terme (z.B. ln
. Logarithmieren wir
Gleichung (2.6) und vernachlässigen konstante oder sich nur
langsam ändernde Terme (z.B. ln 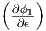 oder ln δE), so
erhalten wir
oder ln δE), so
erhalten wir
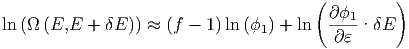 | (2.7) |
Wenn f die Grössenordnung 1024 ist, ist auch f ⋙ ln f. Da ϕ1 ≈ ε ist, ist der zweite Summand auch von der Grösse 1.
Wir betrachten N Moleküle eines monoatomaren Gases. Im allgemeinsten Fall setzt sich die Gesamtenergie aus der kinetischen Energie der Teilchen und der gegenseitigen Lageenergie (potentielle Energie) der Teilchen zusammen.
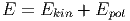 |
Die Anzahl Zustände zwischen E und E + δE sind
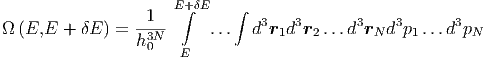 | (2.8) |
Dies sind 6N Integrale über den gesamten Phasenraum des
Systems. Wir haben die Abkürzungen d3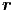 i = dxidyidzi und
d3
i = dxidyidzi und
d3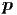 i = dpixdpiydpiz verwendet. Bei einem idealen Gas ohne
gegenseitige Wechselwirkung ist Epot = 0. Deshalb ist das
Integral über die Raumkoordinaten einfach das Volumen zur
N-ten Potenz.
i = dpixdpiydpiz verwendet. Bei einem idealen Gas ohne
gegenseitige Wechselwirkung ist Epot = 0. Deshalb ist das
Integral über die Raumkoordinaten einfach das Volumen zur
N-ten Potenz.
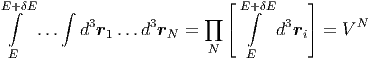 | (2.9) |
Die Integrale über die Impulse dürfen, bei einem idealen Gas, nur von der gesamten kinetischen Energie Ekin abhängen.
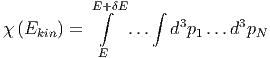 |
Damit erhalten wir
 | (2.10) |
Aus der Mechanik ist bekannt, dass die gesamte kinetische Energie sich als Summe der kinetischen Energien der einzelnen Teilchen schreiben lässt:
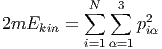 |
Dies ist die Bestimmungsgleichung einer 3N-dimensionalen Kugel. Diese Kugel hat den Radius R(Ekin). Die Anzahl Zustände zwischen 0 und E hängt dann vom Radius R dieser Kugel ab und ist proportional zu
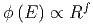 |
Da E ∝ p2 ist, gilt auch
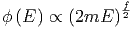 |
In der Kugelschale zwischen E und E + δE liegen
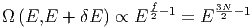 |
Zustände. Hier haben wir verwendet, dass die Anzahl Freiheitsgrade f = 3N ist. Damit ist die Anzahl Zustände im Energiebereich zwischen E und E + δE durch
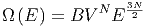 | (2.11) |
gegeben. B ist dabei konstant und unabhängig von V
und E. Das Resultat für Ω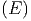 ist abhängig von δE.
Es wird sich jedoch zeigen, dass der Einfluss von δE
für messbare thermodynamische Grössen nicht relevant
ist.
ist abhängig von δE.
Es wird sich jedoch zeigen, dass der Einfluss von δE
für messbare thermodynamische Grössen nicht relevant
ist.
Anzahl Zustände und reversible Prozesse Die Beziehung zwischen der Anzahl Zustände zwischen E und E + δE vor und nach einem Prozess erlauben, festzulegen, ob ein Prozess ein reversibler Prozess ist. Sei Ωi die Anzahl der Zustände im betrachteten Energieintervall bevor wir den Prozess ausführen. Ωf sei entsprechend die Anzahl der Zustände im betrachteten Energieintervall nach Ausführung des Prozesses.
| Ωi = Ωf | reversibler Prozess | |
| Ωi < Ωf | irreversibler Prozess |
Zeitskalen Jedes thermodynamische System hat eine charakteristische Zeit τ, um ins Gleichgewicht zu kommen. Diese charakteristische Zeit muss mit der charakteristischen Zeit für ein Experiment, texp, verglichen werden.
| τ « texp | Das System ist im Gleichgewicht | ⇒ | Statistik gilt |
| τ » texp | Das System kann durch gedachte Beschränkungen im Gleichgewicht gehalten werden | ⇒ | Statistik gilt |
| τ ≈ texp | Nichtgleichgewicht | ⇒ | „Schlamassel“ |

Skizze zweier thermodynamischer Systeme A und A′ im Kontakt.
Wir betrachten die beiden thermodynamischen Systeme A
und A′, die sich im Kontakt binden sollen. Das Gesamtsystem
A0 = A + A′ sei thermisch isoliert. Sei Ω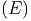 die Anzahl
Zustände von A zwischen E und E + δE und Ω′
die Anzahl
Zustände von A zwischen E und E + δE und Ω′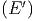 die
Anzahl Zustände von A′ zwischen E′ und E′ + δE′.
die
Anzahl Zustände von A′ zwischen E′ und E′ + δE′.
Der Satz von der Energieerhaltung verlangt, dass
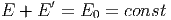 |
ist. Damit kann man die Energie E′ von A′ ausdrücken
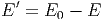 |
Wir bezeichnen mit Ω0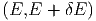 die Anzahl Zustände des
Gesamtsystems A0 zwischen E und E + δE. Da die beiden
thermodynamischen Systeme A und A′ statistisch unabhängig
sind, ist die Anzahl der Zustände des Gesamtsystems
das Produkt der Anzahl Zustände des Systems A, also
Ω
die Anzahl Zustände des
Gesamtsystems A0 zwischen E und E + δE. Da die beiden
thermodynamischen Systeme A und A′ statistisch unabhängig
sind, ist die Anzahl der Zustände des Gesamtsystems
das Produkt der Anzahl Zustände des Systems A, also
Ω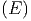 , und der Anzahl Zustände des Systems A′, und
Ω′
, und der Anzahl Zustände des Systems A′, und
Ω′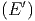 = Ω′
= Ω′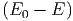 .
.
Die Wahrscheinlichkeit des Zustandes Ω0 des Gesamtsystems ist
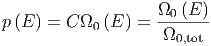 |
Dabei ist C eine noch unbekannte Konstante und Ω0,tot die Gesamtzahl aller möglicher Zustände summiert über alle Energien.
Da die beiden thermodynamischen Systeme A und A′ statistisch unabhängig sind, gilt
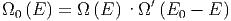 | (2.12) |
Deshalb gilt für das Gesamtsystem A0 die Wahrscheinlichkeit
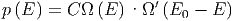 | (2.13) |
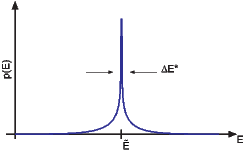
Breite der Verteilungsfunktion
Für p(E) gilt:
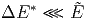 |
Begründung:
 |
Daraus folgt für den Logarithmus von p
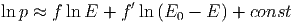 |
Dabei existieren die folgenden Grenzwerte
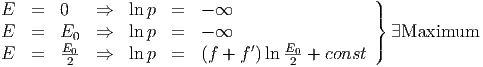 | (2.14) |
Das Maximum von p ist sehr viel schärfer als das Maximum von ln p.
Wie gross ist Ẽ? Diese Grösse kann über die Ableitung berechnet werden.
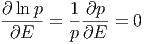 | (2.15) |
Es gilt aber
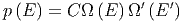 | (2.16) |
Damit und mit 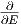 =
= 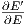
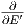 = -
= -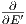 erhalten wir
erhalten wir
| 0 | = 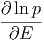 | ||
= 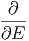 ![[ln C + ln Ω (E) + lnΩ ′(E′)]](td-2015543x.png) | |||
= 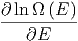 - -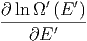 | (2.17) |
Wir setzen
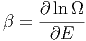 |
und erhalten im Gleichgewicht
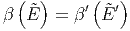 | (2.18) |
mit Ẽ′ = E0 -Ẽ.
Dieses β(E) ist eine Funktion von E und hat als Einheit
![[β ]](td-2015548x.png) =
= 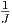 . Andererseits wissen wir, dass auch die Temperatur
eine Funktion der Energie, nämlich der inneren Energie U
ist.
. Andererseits wissen wir, dass auch die Temperatur
eine Funktion der Energie, nämlich der inneren Energie U
ist.
Dabei ist k die Boltzmannkonstante und T(U) die Temperatur.
Mit der (zuerst rein formalen) Definition der Entropie
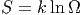 | (2.20) |
bekommt man
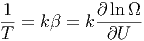 | (2.21) |
und damit
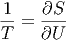 | (2.22) |
S heisst Entropie. Ihre Einheit ist ![[S ]](td-2015554x.png) =
= ![[ ]
JK-](td-2015555x.png) .
.
ist die statistische Definition der Entropie |
|
In unserer Herleitung hängt die Anzahl der Zustände Ω und
die Entropie S immer noch von der konstanten Breite des
Energieintervalls δE ab. Gleichung Gleichung (2.21) zeigt,
dass β unabhängig von δE ist. Nehmen wir an, dass
das Energieintervall von δE auf δ*E wechselt. Da die
Zustandsdichten gleich sind(ω(E) = ω*(E)), gilt auch
Ω*(E) = 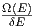 δ*E und damit S* = k ln Ω* = S + k ln
δ*E und damit S* = k ln Ω* = S + k ln 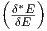 .
Nun hat aber S∕k die Grössenordnung f und ln
.
Nun hat aber S∕k die Grössenordnung f und ln 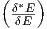 liegt
irgend wo bei einem Wert kleiner 100, so dass in sehr
guter Näherung gilt: S* = S. Damit ist auch die Entropie
unabhängig von der Wahl von δE.
liegt
irgend wo bei einem Wert kleiner 100, so dass in sehr
guter Näherung gilt: S* = S. Damit ist auch die Entropie
unabhängig von der Wahl von δE.
Der wahrscheinlichste Zustand unserer beiden thermodynamischen Systeme im Kontakt ist gegeben durch
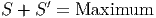 | (2.23) |
Diese Gleichung folgt aus der Bedingung, dass die Wahrscheinlichkeit eines Zustandes nur zunehmen, nicht aber abnehmen darf. Weiter wissen wir von früher, dass die Temperaturen auch gleich sein müssen.
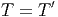 | (2.24) |
Aus der statistischen Physik kann man ableiten:
| Im Gleichgewicht zweier thermodynamischer
Systeme sind ihre Temperaturen gleich und die
gesamte Entropie S maximal. |

Überströmversuch
Beim Überströmversuch betrachtet man zwei Zustände, in denen ein System von N Teilchen sich befinden kann.
| Bezeichnung | Zustand | Anzahl | Wahrscheinlichkeit | Entropie |
| A | alles links | ΩA = 1 | pA = 2-N | S A = 0 |
| B | gleichverteilt | ΩB ≈ 2N | p B ≈ 1 | SB ≈ kN ln 2 |
Wenn das Gas also aus dem Zustand „alles links“ in den gleichverteilten Zustand wechselt, ändert sich die Entropie um
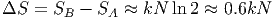 |
Wenn N = 1023 Teilchen aus A in A + A′ strömen,
nimmt die Entropie um 1.3·10-23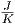 ·1023·0.6 ≈ 1
·1023·0.6 ≈ 1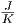 zu.
Andererseits müsste die Entropie um den gleichen Wert
abnehmen, wenn alle Teilchen aus dem gleichverteilten
Zustand nach A strömen sollten.
zu.
Andererseits müsste die Entropie um den gleichen Wert
abnehmen, wenn alle Teilchen aus dem gleichverteilten
Zustand nach A strömen sollten.
Spielkarten Bei 52 Karten gibt es
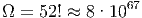 |
mögliche Anordnungen. Die Ausgangssituation hatte Ω1 = 1 möglichen Zustand. Nach dem Mischen der Karten hat die Entropie um
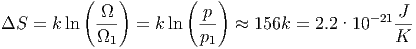 |
zugenommen.
Mischen zweier Substanzen Wir mischen den Inhalt einer Kiste mit 1013 weissen Sandkörnern mit dem Inhalt einer Kiste mit 1013 schwarzen Sandkörnern. Die Wahrscheinlichkeit vorher ist p1 = 2-N = 2-1013. Nach dem Mischen ist die Wahrscheinlichkeit des Zustandes p ≈ 1. Die Entropie nimmt beim Mischen um
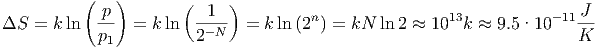 |
Eigenschaften der Temperatur
Wir wissen, dass die Beziehungen
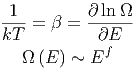 | (2.25) |
![∂ ln Ω(E ) ∂ [f ln E] f
----------= --------- = --
∂E ∂E E](td-2015570x.png) |
nimmt β mit zunehmendem E sehr schnell ab.
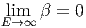 |
Weiter gilt, dass für alle E > 0 auch β > 0 ist.
Wenn E eine obere Grenze hat dann gibt es Energien für die
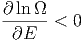 | (2.27) |
ist, also T < 0 ist. Beispiele dafür sind Spins oder 2-Niveau-Systeme (Laser).
Aus Ω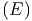 ~ Ef folgt
~ Ef folgt
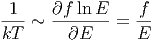 |
und weiter, dass
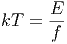 | (2.28) |
ist. kT misst also die Energie pro Freiheitsgrad.
Wenn kein Gleichgewicht herrscht, fliesst die (infinitesimale)
Wärme Q = Ẽf -Ẽi = -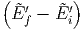 zwischen den beiden
Wärmereservoiren. Die Entropie nimmt dann zu mit
zwischen den beiden
Wärmereservoiren. Die Entropie nimmt dann zu mit
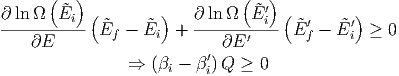 | (2.29) (2.30) |
| βi | ≥ βi′ und | ||
| Ti | ≤ Ti′ |
also Wärme wird vom System mit den höheren β (kleinerem T) absorbiert und von niederen β (höherem T) abgegeben.
 Lizenzinformationen
Lizenzinformationen