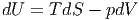

Die Maxwellrelationen sind die Konsequenz der Anwendung der Differentialrechnung auf den ersten Hauptsatz.
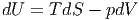 | (2.1) |
Die innere Energie U wird als Funktion der Entropie S und des Volumens V angesehen.
| U | = U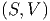 | (2.2) |
U kann als totales Differential geschrieben werden:
| dU | = 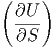 V dS + V dS + 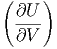 SdV SdV | (2.3) |
Die Gleichungen (2.1) und (2.3) beschreiben das gleiche thermodynamische System. Da dS und dV beliebig wählbar sind (unabhängige Variablen) müssen ihre Koeffizienten gleich sein:
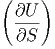 V V | = T | (2.4) |
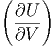 S S | = -p | (2.5) |
Die gemischten zweiten Ableitungen sind unabhängig von der Reihenfolge.
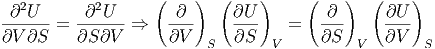 | (2.6) |
Damit erhält man
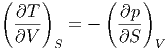 | (2.7) |
Das betrachtete thermodynamische System soll durch die freien Variablen S und p beschrieben werden. Dies bedeutet, dass das Volumen V eine Konsequenz des angelegten Druckes p sein soll. Das Differential d(pV ) ausgerechnet ist
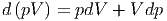 | (2.8) |
Umgestellt erhalten wir
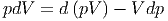 | (2.9) |
d(pV ) wird links und rechts addiert
| dU + d(pV ) | = TdS - pdV + d(pV ) | ||
| = TdS - pdV + pdV + V dp | |||
| = TdS + V dp | |||
d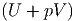 | = TdS + V dp | (2.10) |
Wir definieren die Enthalpie H
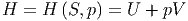 | (2.11) |
Analog zum ersten Hauptsatz erhalten wir mit den unabhängigen Variablen S und p
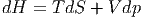 | (2.12) |
Andererseits kann dH als totales Differential geschrieben werden
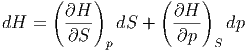 | (2.13) |
Der Koeffizientenvergleich ergibt die beiden Beziehungen
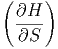 p p | = T | (2.14) |
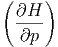 S S | = V | (2.15) |
Wieder sind die gemischten zweiten Ableitungen unabhängig von der Reihenfolge.
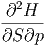 | = 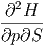 | ||
| (2.16) |
Damit erhalten wir die Beziehung
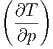 S S | = 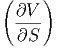 p p | (2.17) |
Das betrachtete thermodynamische System soll durch die freien Variablen T und V beschrieben werden. Dies bedeutet, dass die Entropie S eine Konsequenz der herrschenden Temperatur T sein soll. Das Differential d(TS) ausgerechnet ist
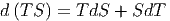 | (2.18) |
Umgestellt erhalten wir
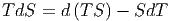 | (2.19) |
d(TS) wird links und rechts subtrahiert
| dU - d(TS) | = TdS - pdV - d(TS) | ||
| = TdS - pdV - TdS - SdT | |||
| d(U - TS) | = -SdT - pdV | (2.20) |
Wir nennen die Grösse
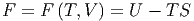 | (2.21) |
die freie Energie (manchmal auch Helmholtzsche freie Energie). In der nicht-deutschsprachigen Literatur wird anstelle von F oft auch A geschrieben. dF ist wieder ein totales Differential.
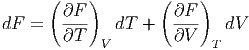 | (2.22) |
Der Koeffizientenvergleich ergibt die beiden Beziehungen
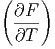 V V | = -S | (2.23) |
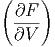 T T | = -p | (2.24) |
Die Reihenfolge der gemischten zweiten Ableitungen kann vertauscht werden.
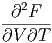 | = 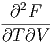 | ||
| (2.25) |
Damit erhalten wir die Beziehungen
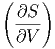 T T | = 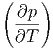 V V | (2.26) |
Das betrachtete thermodynamische System soll durch die freien Variablen T und p beschrieben werden. Dies bedeutet, dass die Entropie S eine Konsequenz der herrschenden Temperatur T und das Volumen V durch den Druck p bestimmt sein soll. Wir addieren nun im ersten Hauptsatz auf beiden Seiten d(pV ) - d(TS) und erhalten
| dU + d(pV ) - d(TS) | = TdS - pdV + d(pV ) - d(TS) | ||
= TdS - pdV - d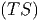 + d + d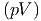 | |||
| = TdS - pdV - TdS - SdT + pdV + V dp | |||
| d(U + pV - TS) | = -SdT + V dp | (2.27) |
Wir nennen die Grösse
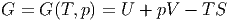 | (2.28) |
die freie Enthalpie oder die Gibbssche freie Energie. dG ist ein totales Differential
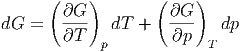 | (2.29) |
Durch Koeffizientenvergleich erhält man
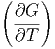 p p | = -S | (2.30) |
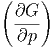 T T | = V | (2.31) |
Die Reihenfolge der gemischten zweiten Ableitungen kann gewechselt werden.
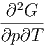 | = 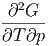 | ||
| (2.32) |
Damit erhalten wir die Beziehung
-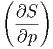 T T | = 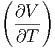 p p | (2.33) |
Die vier aus den zweiten Ableitungen der thermodynamischen energetischen Zustandsfunktionen U, F, H, und G abgeleiteten Beziehungen heissen Maxwellrelationen.
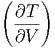 S S | = -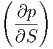 V V | (2.34) |
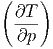 S S | = 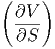 p p | (2.35) |
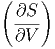 T T | = 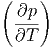 V V | (2.36) |
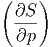 T T | = -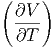 p p | (2.37) |
Die vier Maxwellrelationen folgen alle aus der Tatsache, dass die Anzahl zugänglicher Zustände eines thermodynamischen Systems dieses System beschreibt (in der Quantenmechanik eindeutig, sonst bis auf eine additive Konstante der Entropie).
U(S,V ), F(T,V ), H(S,p) und G(T,p) heissen thermodynamische Potentiale. Dieser Begriff ist verwirrend, da anders als im Rest der Physik diese Grössen die Einheit einer Energie haben.

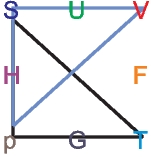
Eselsbrücke für thermodynamische Potentiale
Die thermodynamischen Potentiale stehen in dieser Darstellung in der Mitte der Quadrate. Die unabhängigen Variablen sind immer die benachbart zu dem jeweiligen Potential. So steht H zwischen S und p.
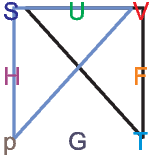
Die Maxwellrelation 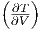 S = -
S = -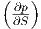 V . Hier
zeigen die Spitzen der Dreiecke nach unten, und
wir haben ein Minuszeichen in der Relation.
V . Hier
zeigen die Spitzen der Dreiecke nach unten, und
wir haben ein Minuszeichen in der Relation.
Die Maxwellrelation 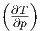 S =
S = 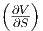 p.
p.
Die Maxwellrelation 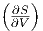 T =
T = 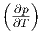 V .
V .
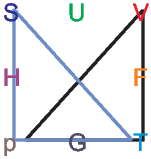
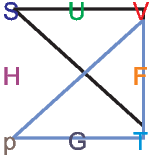
Die Maxwellrelation 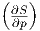 T = -
T = -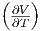 p. Hier
zeigen die Spitzen der Dreiecke nach oben, und wir
haben ein Minuszeichen in der Relation.
p. Hier
zeigen die Spitzen der Dreiecke nach oben, und wir
haben ein Minuszeichen in der Relation.
Bei der Berechnung der Eigenschaften der inneren Energie U hatten wir festgestellt, dass im Gleichgewicht die Entropie S maximal und die innere Energie U minimal ist. Dabei war immer die Nebenbedingung, dass das System von der Umwelt isoliert sei, das heisst dass δQ = 0 war (adiabatische Prozesse), und dass das Volumen konstant war, dV = 0 (isochore Prozesse). In diesem Kapitel interessieren wir uns für die Gleichgewichtsbedingungen, wenn andere Randbedingungen als δQ = 0 und dV = 0 gelten.
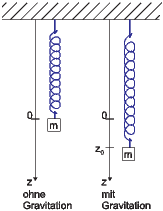
Links ist das Feder-Masse-Pendel ohne Gravitationsfeld zu sehen, rechts mit Gravitationsfeld.
Ein Feder-Masse-Pendel wird durch die Federkraft
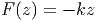 |
beschrieben. Dies führt zur potentiellen Energie
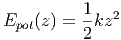 |
Wird nun die Gravitation eingeschaltet, so verlängert sich die Feder wegen der Gravitationskraft F(z) = mg auf
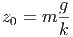 |
Die Gravitation hat die potentielle Energie
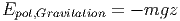 |
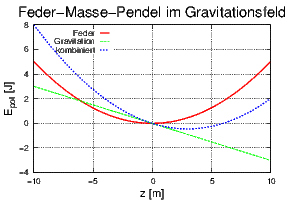
Einfluss der Gravitation auf die potentielle Energie beim Feder-Masse-Pendel.
Abbildung 2.19.7.1 zeigt, wie das Anschalten der Gravitation den Ort des Minimums verändert. Wenn also die Nebenbedingungen (manchmal auch Randbedingungen genannt) ändern, so ändert sich die Gleichgewichtslage. Wir wollen im Folgenden untersuchen, wie andere als die adiabatisch-isochoren Randbedingungen die Gleichgewichtslage ändern.
Um klar abzugrenzen, welche Randbedingungen angewendet werden, wenn die Gleichgewichtslage gesucht wird, wird für jedes Paar von Randbedingungen eine andere Energie definiert. Diese Energiefunktionen werden thermodynamische Potentiale genannt. So würde man ja auch
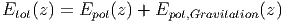 |
schreiben. Dabei ist Etot(z) ein neuer Name, der einem die Bequemlichkeit erlaubt, nicht immer die Summe hinschreiben zu müssen. Genauso verwendet man ausser der inneren Energie die Enthalpie, die freie Enthalpie und die freie Energie. Jede dieser Energien steht für ein anderes Paar von Randbedingungen. Die Namen der Energiefunktionen sind im Laufe der Physikgeschichte zugewiesen worden.
Jedes System, das nicht adiabatisch ist, erlaubt den Wärmeaustausch mit der Umgebung. Um die Gleichgewichtsbedingungen zu finden, müssen wir deshalb das System und die Umgebung gemeinsam betrachten! Bei einem offenen System ist die Entropie
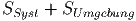 |
maximal. Wenn die Wärmemenge δQ von der Umgebung ans
System übertragen wird, ist die Entropieänderung dS = 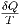 .
Im Gleichgewicht wird dS = 0. Nach dem ersten Hauptsatz
ist
.
Im Gleichgewicht wird dS = 0. Nach dem ersten Hauptsatz
ist
| dS | = 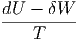 | ||
| dU - δW - TdS | = 0 | ||
| (2.38) |
Hierbei wird angenommen, dass nur mechanische Arbeit möglich ist. Also ist
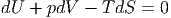 | (2.39) |
Wenn das Volumen zwangsweise konstant gehalten wird, entfällt die Druckarbeit pdV . Wenn weiter auch die Temperatur konstant gehalten wird, ist SdT = 0. Diese Grösse kann also subtrahiert werden. Gleichung (2.39) wird dann
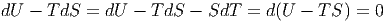 |
Dies ist die Bedingung für ein Extremum. Nun ist aber im Gleichgewicht U minimal und S maximal. Deshalb ist F = U - TS im Gleichgewicht minimal, sofern T und V konstant sind.
| Bei isotherm-isochoren Bedingungen (T = const und
V = const) ist die freie Energie
minimal. |
|
Wenn p und T konstant sind, kann man Gleichung (2.39) durch V dp = 0 und SdT = 0 ergänzen und erhält
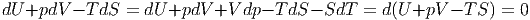 |
Im Gleichgewicht befindet sich das System im mechanischen Energieminimum (U + pV ) und im Entropiemaximum. Deshalb ist G = U + pV - TS minimal, wenn p und T konstant sind.
| Bei isotherm-isobaren Bedingungen (T = const und
p = const) ist die freie Enthalpie
minimal. |
|
Ohne Wärmeaustausch ist TdS = 0. Wenn gleichzeitig der Druck p konstant ist, entfällt in Gleichung (2.39) der Term TdS und wir können V dp = 0 addieren.
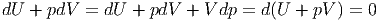 |
Im Gleichgewicht befindet sich das System im mechanischen Energieminimum (U + pV )m. Deshalb ist H = U + pV minimal, wenn p konstant ist in einem adiabatischen Prozess.
| Bei adiabatisch-isobaren Bedingungen (δQ = 0 und
p = const) ist die Enthalpie
minimal. |
|
Adiabatisch-isobare Bedingungen können mit einem Dewar-Gefäss (thermisch isoliert) mit einem beweglichen Deckel der Masse m im Gravitationsfeld simuliert werden. Wäre der Deckel fixiert, hätten wir die adiabatisch isochoren Bedingungen, die ein Minimum der inneren Energie U fordern. Beim beweglichen Deckel liegt die Gleichgewichtslage anders, wie aus dem Beispiel mit dem Feder-Masse-Pendel im Gravitationsfeld (Abbildung 2.19.7.1) zu ersehen ist. Die Gleichgewichtslage ist nun durch die kombinierte Energie bestehend aus der inneren Energie und der Gravitationsenergie gegeben!
Schliesslich entfällt in Gleichung (2.39) sowohl pdV wie auch TdS, wenn das Volumen V konstant gehalten wird und kein Energieaustausch δQ = 0 vorkommt.
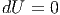 |
| Bei adiabatisch-isochoren Bedingungen (δQ = 0 und
V = const) ist die innere Energie
minimal. |
|
Je nach den Bedingungen (isobar, isotherm, usw) kann man mit dem entsprechenden thermodynamischen Potential den Reaktionsweg und die Reaktionsrichtung bestimmen.
 Lizenzinformationen
Lizenzinformationen