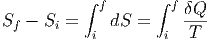

In diesem Abschnitt wollen wir die Eigenschaften der Entropie untersuchen. Wir betrachten dazu zwei Makrozustände i (initial) und f (final). Für die Entropieänderung erhalten wir allgemein
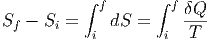 | (2.1) |
Diese Integrale gelten für quasistatische Prozesse, also
Prozesse bei denen das untersuchte System immer im
Gleichgewicht ist. Sie sind aber unabhängig vom Prozess. Die
Aussage, dass ∫
if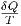 unabhängig vom Weg ist, ist äquivalent
zur Aussage, dass die potentielle Energie in konservativen
Kraftfeldern unabhängig vom Weg sei.
unabhängig vom Weg ist, ist äquivalent
zur Aussage, dass die potentielle Energie in konservativen
Kraftfeldern unabhängig vom Weg sei.
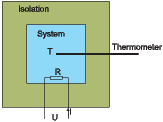
Skizze einer Apparatur zur Messung der Entropie. Mit dem Widerstand R wird die Heizleistung P = UI in das thermisch isolierte System gebracht. Das Thermometer misst die Temperatur T.
Gleichung (2.1) zeigt, wie Entropiedifferenzen gemessen werden können. Wir nehmen an, dass sich das System im Gleichgewicht bei der Temperatur T1 befindet. Nun wird mit dem Widerstand die Wärmemenge
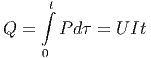 |
in der Zeit t in das System gebracht. Die Temperatur steigt dann wie T(t). Wenn wir also
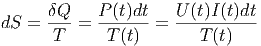 |
integrieren, erhalten wie die Entropiedifferenz.
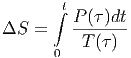 | (2.2) |
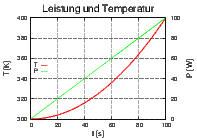
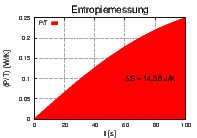
Links ist T(t) und P(t) gezeigt, rechts 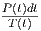 . Die
ausgefüllte Fläche ist die Entropiedifferenz ΔS.
. Die
ausgefüllte Fläche ist die Entropiedifferenz ΔS.
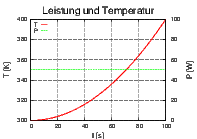

Links ist T(t) und P(t) gezeigt, rechts 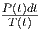 . Die
ausgefüllte Fläche ist die Entropiedifferenz ΔS.
. Die
ausgefüllte Fläche ist die Entropiedifferenz ΔS.
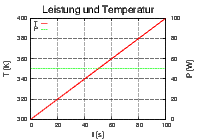
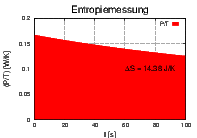
Links ist T(t) und P(t) gezeigt, rechts 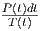 . Die
ausgefüllte Fläche ist die Entropiedifferenz ΔS.
. Die
ausgefüllte Fläche ist die Entropiedifferenz ΔS.
Da die Entropie als S = k ln Ω geschrieben werden kann, hängt die Entropie eindeutig vom Makrozustand des Systems ab, wenn wir das Phasenraumvolumen auf h0 = ℏ fixieren. Bei einer klassischen Betrachtung würde gelten
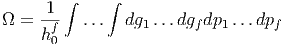 |
und damit
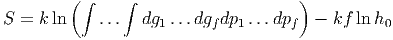 |
Das heisst, dass bei klassischer Betrachtung S nicht eindeutig definiert ist. Erst die Quantenmechanik mit dem von Planck gefundenen Phasenraumvolumen macht die Betrachtung eindeutig, also h0 = ℏ!
Wir nehmen nun an, dass der niedrigste mögliche Energiegehalt eines Systems E0 sei. Diese niedrigste Energie entspricht der Nullpunktsenergie in der Quantenmechanik. Für die folgende Betrachtung ist nicht wichtig, woher E0 rührt, sondern dass sie existiert. Für E → E0 gilt
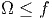 |
Damit muss
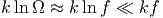 |
sein für Energien E in der Nähe der Grundzustandsenergie E0. Wir erhalten also für E → E0. Damit wird die Entropie bei kleinen Energien S = k ln Ω ≈ k ln f viel kleiner als die Entropie bei hohen Energien S = k ln Ω ≈ kf ln E. Damit haben wir also
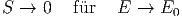 | (2.3) |
Weiter wissen wir aus der Definition von λ in der Gleichung (2.2) und dem Vorzeichen aus Gleichung (2.8) dass
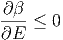 |
ist. Damit ist aber
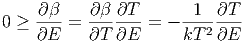 |
Also muss auch
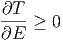 | (2.4) |
Dies bedeutet, dass die Energie mit der Temperatur zunehmen muss. Umgekehrt heisst das natürlich, dass die Temperatur mit abnehmender Energie abnehmen muss. Damit ist auch
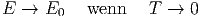 | (2.5) |
| 3. Hauptsatz (strenge Form) Wenn T gegen 0 geht, verschwindet die Entropie, also ist lim T→0S = 0 Max Planck |
Es gibt nun Systeme (zum Beispiel Gläser), die bei T = 0 in metastabile Zustände mit praktisch unendlicher Lebensdauer geraten. Diese metastabilen Systeme sind nicht im Grundzustand, deshalb ist lim T→0 > 0.
| 3. Hauptsatz (engere Form) Für T → 0 gilt, dass lim T→0ΔS = 0 ist. Alternativ bedeutet das, dass lim T→0S = S0, wobei S0 unabhängig von allen Parametern des betreffenden Systems ist. |
Die Wärmekapazitäten von Stoffen hängen mit der Entropie zusammen. Aus
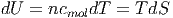 |
folgt
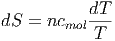 |
und nach der Integration
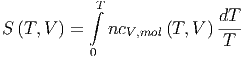 |
und
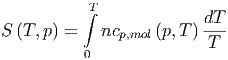 |
Also sind die Grenzwerte für die Wärmekapazitäten
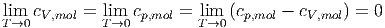 | (2.6) |
Insbesondere verschwindet die Differenz von cp,mol und cV ,mol wenn die Temperatur gegen den absoluten Nullpunkt geht. Unser früheres Resultat für das ideale Gas cp,mol = cV ,mol + R gilt also nur für hohe Temperaturen. In anderen Worten: in der Nähe des Temperaturnullpunktes gibt es keine idealen Gase.
Wir hatten früher den Wirkungsgrad von Wärmekraftmaschinen abgeleitet:
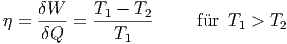 | (2.7) |
Analog gilt für Kältemaschinen:
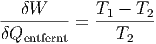 | (2.8) |
Kann man den Temperaturnullpunkt mit einer Kältemaschine erreichen? Für T2 → 0 gilt
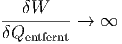 |
Das heisst, es muss immer mehr mechanische Energie in ein System gesteckt werden, um die Temperatur weiter zu erniedrigen. Da diese Energie divergiert, muss
 |
sein. Das bedeutet:
| Mit einer Kältemaschine ist der absolute
Temperaturnullpunkt nicht erreichbar. |
Dies ist eine alternative Fassung des dritten Hauptsatzes.
Bemerkung:
Es gilt auch
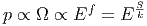 |
 Lizenzinformationen
Lizenzinformationen