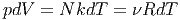

Aus dem idealen Gasgesetz (Gleichung (2.13)) folgt bei konstantem Druck p und Teilchenzahl N, dass
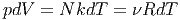 |
ist.
Der erste Hauptsatz (Gleichung (2.1)) besagt, dass
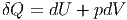 |
sei.
Setzen wir die Definition für die Wärmekapazität bei konstantem Volumen (Gleichung (2.18)) und das ideale Gasgesetz ein, so erhalten wir
![δQ = νc dT + νRdT = ν [c + R ]dT
V,mol V,mol](td-2015136x.png) |
Andererseits ist die Wärmezufuhr pro Mol bei konstantem Volumen gegeben durch
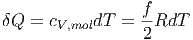 |
Also erhält man pro Mol
![( )
c dT = [c + R]dT = f-+ 1 RdT
p,mol V ,mol 2](td-2015138x.png) |
Aus den Zeiten vor dem SI-System kennt man das Wärmeäquivalent
| 1kcal | = 4.1kJ | ||
| 1cal | = 4.1J |
Bei schnellen Zustandsänderungen in Gasen (zum Beispiel bei Schallwellen) kann ein thermodynamisches System sich nicht mit der Umgebung durch Wärmeaustausch ins Gleichgewicht bringen. Für diese adiabatischen Zustandsänderungen gilt
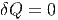 |
Wir erhalten aus der idealen Gasgleichung (Gleichung (2.13))
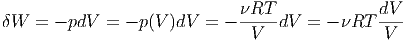 |
Die Wärmezufuhr wird durch
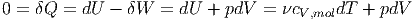 |
beschrieben. Aus diesen beiden Gleichungen erhält man durch Kombination
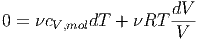 |
Wir teilen durch T und eliminieren ν
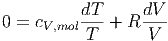 | (2.2) |
Aus dieser Gleichung folgt durch Integrieren
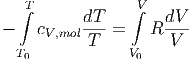 |
und
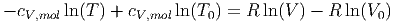 |
Daraus erhalten wir die Beziehung
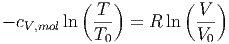 | (2.3) |
oder auch
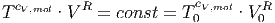 |
Dies kann auch als
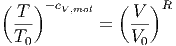 |
umgeschrieben werden. Mit cV ,mol = 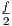 R bekommt man durch
Ziehen der R-ten Wurzel
R bekommt man durch
Ziehen der R-ten Wurzel
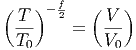 | (2.4) |
Wir definieren nun den Adiabatenexponenten
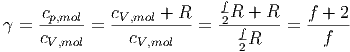 | (2.5) |
Umgeschrieben lautet die Gleichung
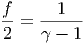 |
Damit bekommen wir die Gleichung
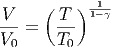 | (2.6) |
oder, umgekehrt
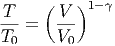 | (2.7) |
Aus der Gleichung (2.13) für das ideale Gas folgt
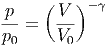 | (2.8) |
und
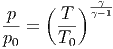 | (2.9) |
Da bei einem Adiabatischen Prozess wie der Schallausbreitung in der Atmosphäre keine Energie ausgetauscht wird, gilt
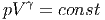 |
und nicht, wie man aus der idealen Gasgleichung entnehmen würde
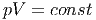 |
| Die
ideale Gasgleichung gilt nur bei quasistatischen
Prozessen mit Energieaustausch, nicht aber bei
adiabatischen Prozessen (d. h., bei Prozessen
ohne Energieaustausch. |
Prozesse werden mit Zustandsdiagrammen beschrieben:
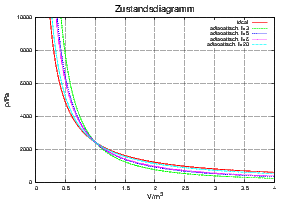
Zustandsdiagramm T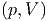 für das ideale Gas und
adiabatische Änderungen für die Anzahl
Freiheitsgrade f = 3, f = 5, f = 6 und f = 20.
für das ideale Gas und
adiabatische Änderungen für die Anzahl
Freiheitsgrade f = 3, f = 5, f = 6 und f = 20.
Adiabatische Prozesse nähern sich mit höheren Freiheitsgraden den isothermen Prozessen an.
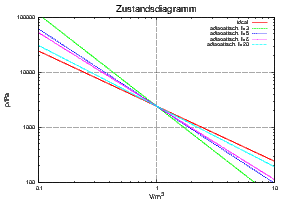
Doppelt logarithmische Darstellung des
Zustandsdiagramms T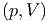 für das ideale Gas und
adiabatische Änderungen für die Anzahl
Freiheitsgrade f = 3, f = 5, f = 6 und f = 20.
für das ideale Gas und
adiabatische Änderungen für die Anzahl
Freiheitsgrade f = 3, f = 5, f = 6 und f = 20.
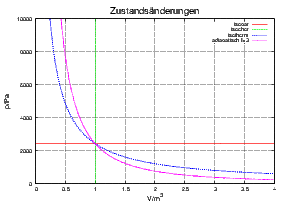
Darstellung der häufigsten Typen von Zustandsänderungen
Die Druckarbeit bei den verschiedenen Zustandsänderungen hat jeweils die folgende Grösse:
| Druckarbeit | Zustandsänderung |
| δW = pdV | isobar |
W = U1 - U2 = CV ,molν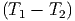 | adiabatisch |
W = ∫
pdV = νRT ∫
V 1V 2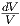 = νRT ln = νRT ln 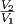 | isotherm |
| W = 0 | isochor |
 Lizenzinformationen
Lizenzinformationen